微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
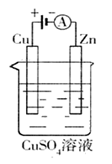
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是 ;
正极的电极反应式是 。
(3)下图是一个电化学过程示意图。
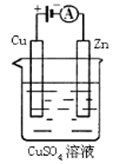
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
参考答案:(1)N2H4(1)+O2(g) =N2(g)+2H2O(1);△H=
本题解析:
本题难度:一般
2、选择题 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)→2HCl(g)+Q1 H2(g)+Br2(g)→2HBr(g)+Q2 有关上述反应的叙述正确的是
[? ]
A.Q1> Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.l mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
参考答案:AD
本题解析:
本题难度:简单
3、填空题 2005年我国成功发射“神州”六号载人飞船,标志着我国航天技术走在了世界前列。肼(N2H4)是发射航天飞船常用的高能燃料。在火箭推进器中分别装有肼和过氧化氢,当它们混合时即产生气体,并放出大量的热。已知12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出液态肼与过氧化氢反应生成液态水的热化学方程式____________________。
参考答案:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-817.625kJ/mol
本题解析:
本题难度:一般
4、填空题 (1)在25℃、101kPa状况下,4g氢气和适量氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______.
(2)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构,如图所示;现提供以下化学键的键能:P-P?198KJ?mol-1,P-O?360kJ?mol-1氧气分子内氧原子间的键能为498kJ?mol-1则P4+3O2=P4O6的△H为______;
(3)下表是稀硫酸与某金属反应的实验数据:
实验
序号 | 金属
质量/g | 金属
状态 | C(H2SO4)
/mol?L-1 | V(H2SO4)
/mL | 溶液温度/℃ | 金属消失
的时间/s
反应前
反应后
1
0.10
丝
0.5
50
20
34
500
2
0.10
粉末
0.5
50
20
35
50
3
0.10
丝
0.7
50
20
36
250
4
0.10
丝
0.8
50
20
35
200
5
0.10
粉末
0.8
50
20
36
25
6
0.10
丝
1.0
50
20
35
125
7
0.10
丝
1.0
50
35
50
50
8
0.10
丝
1.1
50
20
34
100
|
分析上述数据,回答下列问题:
①实验4和5表明,______对反应速率有影响,能表明同一规律的实验还有______(填实验序号);
②仅表明反应物浓度对反应速率产生影响的实验有______(填实验序号);
③本实验中除上述中所列的因素外,影响反应速率的其他因素还有______,其实验序号是______.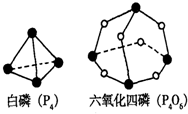
参考答案:(1)生成1mol水蒸气放热241.8kJ,在反应2H2(g)+O2(g)═2H2O(g)中,
生成2molHCl放出2×241.8kJ=483.6kJ,则热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
故答案为:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;
(2)各化学键键能为P-P?198kJ?mol-1、P-O?360kJ?mol-1、O=O?498?kJ?mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+3O2=P4O6的反应热△H=6×198kJ?mol-1+3×498kJ?mol-1-12×360kJ?mol-1=-1638kJ?mol-1,
故答案为:-1638kJ?mol-1;
(3)①对比实验4和5,反应物的浓度和实验温度相同,但固体的不同,粉末状金属反应速率达,探究的是表面积对反应速率的影响,其中1和2实验能表明同一规律,
故答案为:固体表面积;1和2;
②2和5实验,固体变面积相同,温度相同,但反应物的浓度不同,二者探究的而是浓度对反应速率的影响,
故答案为:2和5;
③6和7实验固体的表面积相同,反应物的浓度不同,但反应的温度不同,探究的是温度对反应速率的影响,
故答案为:温度;6和7.
本题解析:
本题难度:一般
5、选择题 氢气、一氧化碳、葡萄糖、甲烷燃烧的热化学方程式分别为
H2(g)+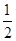 O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1
O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+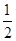 O2(g) = CO2(g) ΔH=-283.0 kJ·mol-1
O2(g) = CO2(g) ΔH=-283.0 kJ·mol-1
C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=
参考答案:
本题解析:
本题难度:一般