微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:
(1)H2(g)+1/2O2(g)===H2O(g); △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g); △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l); △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l); △H4=d kJ·mol-1
下列关系式中正确的是
[? ]
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列化学用语书写正确的是?
[? ]
A.次氯酸的电离方程式:HClO H++ ClO-
H++ ClO-
B.铝溶于烧碱溶液的离子方程式:Al+ 2OH-= AlO2-+H2↑
C.电解精炼铜的阴极反应式:Cu -2e-=Cu2+
D.已知中和热为57.3 kJ.mol-1,稀硫酸与氢氧化 钠稀溶液反应的热化学方程式:
H2SO4(aq)+ 2NaOH(aq)=Na2SO4(aq)+2H2O(l) △H= - 114.6 kJ.mol-1
参考答案:AD
本题解析:
本题难度:一般
3、选择题 已知充分燃烧a g乙炔气体时生成l mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
[? ]
A.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) △H=-4bkJ/mol
B.2C2H2(g)+5/2O2(g)==4CO2(g)+2H2O(l) △H=2bkJ/mol
C.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) △H=-2bkJ/mol
D.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) △H=bkJ/mol
参考答案:A
本题解析:
本题难度:简单
4、选择题 火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-533.23 kJ·mol-1
H2O(g)=H2O (l) DH2=
参考答案:
本题解析:
本题难度:一般
5、填空题 (13分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应
| 大气固氮
N2 (g)+O2 (g)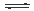 2NO(g) 2NO(g)
| 工业固氮
N2 (g)+3H2 (g)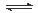 2NH3(g) 2NH3(g)
|
温度/℃
| 27
| 2000
| 25
| 400
| 450
|
K
| 3.84×10-31
| 0.1
| 5×108
| 0.507
| 0.152
|
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。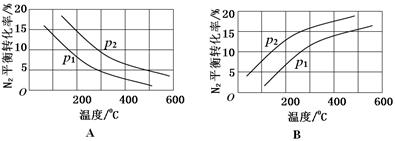
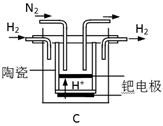
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是_____________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)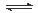 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g)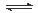 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g)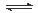 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
参考答案:(1)①吸热(1分)
②K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
(2)A р2>р1
(3)N2+6e-+6H+ 2NH3
2NH3
(4)+1530 kJ·mol-1
本题解析:本题以氮的固定为背景考查原理性知识,通过K随温度的变化判断,大气固氮为吸热反应,而且270C时K值太小,化学反应进行的程度小,不适合大规模生产;人工固氮选择5000C左右,因为考虑到催化剂的活性;分析工业固氮的K随温度变化,确定为放热过程,所以A图正确,正反应为气体体积减小的反应,所以压强大N2的转化率高,所以р2>р1;利用电化学反应制取氨气,通入的氮气发生还原反应,且介质为酸性,从而写出电极反应式:N2+6e-+6H+ 2NH3;2N2(g)+6H2O(1)
2NH3;2N2(g)+6H2O(1)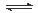 4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol.
4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol.
考点:平衡常数的应用、化学平衡图像、原电池电极反应式的书写、盖斯定律。
本题难度:困难