微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 V?L硫酸铝溶液中含Al3+的质量为m?g,则溶液中SO42-的物质的量浓度为
A.mol?L-1
B.mol?L-1
C.mol?L-1
D.mol?L-1
参考答案:B
本题解析:分析:硫酸铝的化学式为Al2(SO4)3,由n= 先计算Al3+的物质的量,由化学式中离子的关系可确定SO42-的物质的量,然后利用c=
先计算Al3+的物质的量,由化学式中离子的关系可确定SO42-的物质的量,然后利用c= 来计算SO42-的物质的量浓度.
来计算SO42-的物质的量浓度.
解答:Al3+的物质的量为 =
= mol,
mol,
由硫酸铝的化学式为Al2(SO4)3,
则SO42-的物质的量为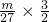 mol=
mol=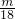 mol,
mol,
则溶液中SO42-的物质的量浓度为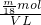 =
=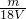 mol?L-1,
mol?L-1,
故选B.
点评:本题考查物质的量浓度的计算,明确物质的量、体积、浓度的关系即可解答,本题的难点是利用铝离子的质量来计算离子的物质的量,将电子的质量忽略不计来分析解答.
本题难度:一般
2、选择题 下列各组液体混合物中,能用分液漏斗分离的是(?)
A.淀粉溶液和食盐溶液
B.乙醇和水
C.苯和溴苯
D.苯和水
参考答案:D
本题解析:只有互不相溶液体之间才能用分液漏斗进行分离,苯不溶于水,其余都是易溶或互溶的,所以答案选D。
本题难度:简单
3、选择题 在MgO中混有少量的Al2O3杂质,欲将杂质除去可选用的试剂是
[? ]
A.稀硫酸 ?
B.浓氨水?
C.稀盐酸 ?
D.氢氧化钠溶液
参考答案:D
本题解析:
本题难度:简单
4、实验题 (12分)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
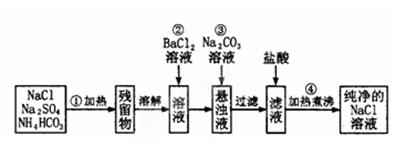
如果此方案正确,那么:
(1)操作①可选择_________?或_________仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么? ______________________________________
(3)进行操作②后,如何判断SO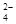 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(4)操作③的目的是___________________,为什么不先过滤后加碳酸钠溶液?理由是___________。
(5)操作④的目的是____________________________________。
参考答案:(1)蒸发皿坩埚
(2)改用Ba(NO3)2会使溶液中引入新的杂质离子NO ,以后操作中无法除去
,以后操作中无法除去
(3)取上层清液加入BaCl2溶液,若无沉淀说明SO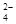 已除尽
已除尽
(4)除去过量的Ba2+?减少一次过滤操作
(5)除去溶解在溶液中的CO2
本题解析:(1)固体加热应该有坩埚。
(2)除杂是不能在引入新的杂质,而改用Ba(NO3)2会使溶液中引入新的杂质离子NO ,以后操作中无法除去,因此不能改为加硝酸钡溶液。
,以后操作中无法除去,因此不能改为加硝酸钡溶液。
(3)判断SO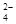 已除尽,方法是继续加入氯化钡溶液,即取上层清液加入BaCl2溶液,若无沉淀说明SO
已除尽,方法是继续加入氯化钡溶液,即取上层清液加入BaCl2溶液,若无沉淀说明SO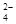 已除尽。
已除尽。
(4)由于溶液中还有钡离子,所以加入碳酸钠的目的是除去过量的Ba2+。不先过滤后加碳酸钠溶液的原因是可以减少一次过滤操作。
(5)加入盐酸酸化时,会生成CO2气体。而溶液中有溶解的CO2,所以加热煮沸的目的是除去溶解在溶液中的CO2。
本题难度:一般
5、选择题 通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钠、氢氧化钠
B.氧化铜、氧化铁
C.氯化钾、氧化铜
D.硫酸铜、氢氧化钠
参考答案:A、硝酸钠、氢氧化钠都溶于水,不能分离,故A错误;
B、氧化铜、氧化铁都不溶于水,也不能分离,故B错误;
C、氧化铜不溶于水,氯化钾溶于水,所以先加水溶解再进行过滤,即可分离,故C正确;
D、硫酸铜、氢氧化钠都不溶于水,且两者反应生成氢氧化铜和硫酸钠,也不能分离,故D错误.
故选C.
本题解析:
本题难度:简单