|
高中化学知识点总结《原电池原理》答题技巧(2017年最新版)(四)
2017-08-22 16:55:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为:Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
总反应式为Ag2O+Zn=ZnO+2Ag。根据上述反应式,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH增大
B.在使用过程中,电子由Ag2O经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn极发生还原反应,Ag2O极发生氧化反应
|
参考答案:C
本题解析:A、原电池工作原理中,化合价升高的那一极是负极,锌是负极电极反应式:Zn+2OH--2e-=ZnO+H2O ,消耗OH-使得pH减小,错误;B、原电池的工作原理,电子从负极经外电路流向正极,锌是负极,氧化银是正极,电子由锌经外电路流向锌,错误;C、原电池工作原理中:化合价升高的那一极作负极,锌作负极,化合价降低的那一极作正极,氧化银作正极,正确;D、锌作负极,化合价升高,被氧化,氧化银作正极化合价降低,被还原,错误。
考点:考查原电池的工作原理。
本题难度:一般
2、选择题 表明金属甲比金属乙活动性强的叙述正确的是
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子;甲比乙氧化性强
C.常温下甲能与浓HNO3反应而乙不能
D.将甲、乙组成原电池时,甲为负极
参考答案:D
本题解析:
本题难度:困难
3、选择题 (2014届江苏省南通市高三第二次调研化学试卷)
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
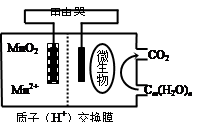
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H++2e—=Mn2++2H2O
参考答案:D
本题解析:
A、原先认为糖均为碳水化合物,符合上式,但后来发现许多糖不符合该式,如鼠李糖(C6H12O5)、脱氧核糖(C5H10O4)等,也有符合该式的不是糖,如甲醛、乙酸(C2H4O2)、乳酸(C3H6O3)等错误;B、微生物放电,糖中碳元素化合价升高失去电子,为负极发生氧化反应,错误;C、原电池中阴离子向负极移动,阳离子向正极移动,错误;D、正确。
本题难度:一般
4、选择题 下列说法违背化学原理的是
A.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量较高
C.A(g)+3B(g)  2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大 2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大
D.在KI溶液中加入氯化银固体,沉淀变成黄色,说明同温度下Ksp(AgI)< Ksp(AgCl)
参考答案:C
本题解析:C项:平衡常数K值减小,故错。故选C。
点评:本题重点考查的是化学基本原理的相关知识。难度易。比较基础,注意基础知识的积累和掌握。
本题难度:一般
5、选择题 对于右图所示的锌、铜和稀硫酸组成的原电池,下列说法正确的是

A.负极的反应式为2H++2e-==H2↑
B.电流由Zn经外电路流向Cu
C.反应一段时间后,溶液中的c(H+)减小
D.溶液中H+向负极移动
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,进程中,锌是负极,失去电子。铜是正极,溶液中的氢离子在正极得到电子生成氢气,所以选项C正确,其余选项都是错误的,答案选C。
点评:该题是高考中的常见题型,属于基础性强试题的考查。试题难易适中,基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和学习效率。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:简单
|