微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列能用同一原理解释的是
A.SO2、Cl2都能使品红溶液褪色
B.NH4Cl晶体、固体碘受热都会汽化
C.福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成
D.苯、乙烯都能使溴水褪色
参考答案:C
本题解析:A中氯气溶于水生成的次氯酸具有强氧化性,有漂白性。SO2和有色化合生成不稳定的无色物质,不是氧化性导致的;B中氯化铵加热易分解生成氯化氢和氨气,是化学变化。碘固体升华是物理变化;C中有机物都含有葡萄糖,能被新制的氢氧化铜悬浊液氧化;D中苯和溴水发生的是萃取,乙烯使溴水褪色,发生的是加成反应,答案选C。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
2、选择题 控制合适的条件,将反应2 Fe3++2 I- 2 Fe2++ I 2 ?设计成如图所示的原电池。下列判断不正确的是
2 Fe2++ I 2 ?设计成如图所示的原电池。下列判断不正确的是
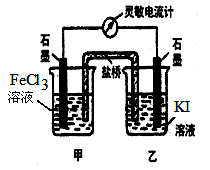
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计 读数为零时,反应达到化学平衡状态
读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中加入FeCl2固体,乙中石墨电极为负极
参考答案:D
本题解析:略
本题难度:一般
3、选择题 微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:?Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
参考答案:AC
本题解析:银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,以此来解答。A、负极发生Zn+2OH--2e-=ZnO+H2O,c(OH-)减小,所以电池负极区溶液的pH减小,故A正确;B、Zn为负极,Ag2O为正极,则使用过程中,电子由Zn极经外电路流向Ag2O极,故B错误;C、Zn失去电子,Zn为负极,Ag2O得到电子是正极,故C正确;D、Zn电极发生氧化反应,Ag2O电极发生还原反应,故D错误;故选AC.
本题难度:一般
4、选择题 一个原电池的总反应离子方程式是Zn+Cu2+═Zn2++Cu,该反应的原电池组成正确( )
| ?A | ?B | ?C | ?D
?正极
?Zn
?Ag
?Cu
?Cu
?负极
?Cu
?Cu
?Zn
?Zn
?电解质溶液
?CuCl2
?H2SO4
?CuSO4
?FeCl2
|
A.A
B.B
C.C
D.D
参考答案:把电池反应方程式拆成两个半电池,发生氧化反应的电极为负极,所以锌作负极;发生还原反应的电极为正极,所以用不如锌活泼的金属或非金属导体作正极;含有发生还原反应的离子溶液为电解质溶液,所以是含有铜离子的溶液.
故选C.
本题解析:
本题难度:简单
5、选择题 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
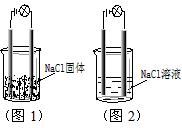
[? ]
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
参考答案:C
本题解析:
本题难度:一般