微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH变化为
[? ]
A.不变
B.先变小,后变大
C.逐渐变大
D.逐渐变小
参考答案:C
本题解析:
本题难度:一般
2、填空题 (1)图1装置发生反应的离子方程式为?。
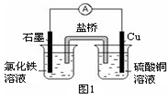 ?
?
(2)图2装置中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
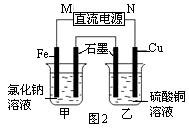
① 电源的M端为?极,甲烧杯中铁电极的电极反应为?。
② 乙烧杯中电解反应的化学方程式为?。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为?mL 。
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式?,
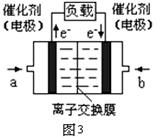
甲醇燃料电池的总反应化学方程式?。
参考答案:(14分)
(1)2Fe3+ + Cu = 2Fe2+ + Cu2+(2分)
(2)① 正(2分),? Fe - 2e-= Fe2+(2分)
② 2CuSO4+ 2H2O 2Cu + O2↑ + 2H2SO4?(2分)? ③ 224(2分)
2Cu + O2↑ + 2H2SO4?(2分)? ③ 224(2分)
(3)O2+4e-+2H2O = 4OH-(2分)? 2CH3OH+4KOH+3O2= 2K2CO3 +6H2O(2分)
本题解析:(1)Fe3+与Cu发生氧化还原反应,离子方程式为2Fe3+ + Cu = 2Fe2+ + Cu2+。
(2)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,
发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,M端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;Fe-2e-═Fe2+;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2Cu2++2H2O 2Cu+O2↑+4H+,
2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为0.64g/64(g/mol) =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol?22.4L
0.02mol ?V
V=(22.4l*0.02mol)/2mol=0.224L,即224ml,故答案为:224。
(3)B极是阳极,通入的O2,得到电子,电极反应式为O2+4e-+2H2O= 4OH-。电解质溶液为KOH溶液,甲烷反应生成的CO2会和KOH反应,故甲醇燃料电池的总反应化学方程式2CH3OH+4KOH+3O2= 2K2CO3 +6H2O。
点评:本题考查电化学知识,题目难度中等,做题时注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算。
本题难度:一般
3、选择题 A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极.A、B、C三种金属的活动顺序为( )
A.A>B>C
B.A>C>B
C.B>C>A
D.B>A>C
参考答案:不同金属混合时,活泼金属先被腐蚀,A中混有C时,A先腐蚀,所以金属性A>C;A与B组成原电池时,A为电池的正极,B为负极,金属性B>A,所以A、B、C三种金属的活动顺序为B>A>C.
故选D.
本题解析:
本题难度:一般
4、简答题 【化学——选修2:化学与技术】(15分)
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:
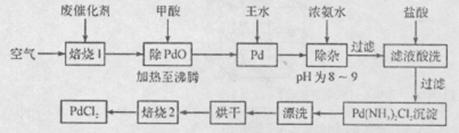
(1)“焙烧1”通入空气的目的是使有机化合物、活性炭等可燃物通过燃烧而除掉,通入空气过多反而不利于实现目的,其原因是 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:___ 。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是 (写化学式)。
(4)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室检测溶液pH的操作方法是: 。
(5)“焙烧2”的目的是: 。
(6)与焙烧2产生的气体组成元素相同的化合物是 ,该物质与空气形成一种环保型碱性燃料电池,其负极反应式为______________________________。
(7) Pd中加入王水的反应可以表示为Pd+HCl+HNO3→A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为 。
参考答案:(1)大量的空气会带走大量的热,使反应器内温度过低,甚至不能发生反应。(2分)
(2) HCOOH+PdO Pd+CO2↑+H2O(2分)
Pd+CO2↑+H2O(2分)
(3)Fe(OH)3(2分)
(4)用洁净的玻璃棒蘸取待测液滴在pH试纸上,与标准比色卡比色,读出pH(2分)
(5)脱氨(使 Pd(NH3)2Cl2生成PdCl2)(2分)
(6)N2H4,(1分)N2H4+4OH
本题解析:
本题难度:困难
5、选择题 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确的是(?)
A.正极反应式为:O2 + 2H2O + 4e- = 4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
参考答案:B
本题解析:根据该电池的总反应知,电池工作时铝失电子,发生氧化反应,作原电池的负极,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上空气中的氧气得电子,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。A、正极上空气中的氧气得电子,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,正确;B、电池工作时,电流由正极流向负极,即从铂电极沿导线流向铝电极,错误;C、以网状的铂为正极,可增大与氧气的接触面积,正确;D、电池工作时,铝电极发生氧化反应而损耗,该电池通常只需更换铝板就可继续使用,正确。
本题难度:一般