微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为(? )
A.6.25 mol /L
B.12.5 mol /L
C.7 mol /L
D.7.5 mol /L
参考答案:A
本题解析:根据质量守恒定律可知,蒸发掉100 g水后的NaOH的质量并没有改变,可以列出如下方程式,设原溶液的质量为m,可以得到m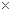 10%=(m-100)
10%=(m-100)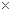 20%,解得m=200g,从而可以算出NaOH的质量为20g即0.5mol,根据
20%,解得m=200g,从而可以算出NaOH的质量为20g即0.5mol,根据
c=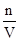 =
=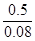 ?mol /L="6.25" mol /L?,故答案为A
?mol /L="6.25" mol /L?,故答案为A
点评:本题考查物质的量浓度的相关计算,难度不大。但解答此题的关键在于利用质量守恒定律。
本题难度:简单
2、计算题 (8分)臭氧(O3)能与KI溶液反应,生成O2等。在反应后的溶液中滴入酚酞变为红色,若滴入淀粉则变为蓝色。为测定某环境空气中的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使之完全反应,所得溶液用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点。反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI。
(1)臭氧通入KI溶液中的化学方程式:?
(2)滴定过程中选择的指示剂是?,达到滴定终点时的现象为?;
(3)计算该空气中臭氧的体积分数。
参考答案:(8分)
(1)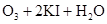 ===
===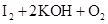 ?(2分)
?(2分)
(2)淀粉?(1分)?溶液由蓝色变为无色(1分)
(3)由化学方程式得:
O3————————————I2————————————2Na2S2O3
1mol? 2mol
n(O3)? 0.0100mol/L×0.0600L
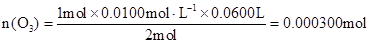 ………………(2分)
………………(2分)
则大气中臭氧的体积分数为: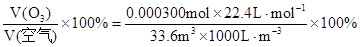
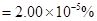 ……………………………………(2分)
……………………………………(2分)
本题解析:
(1)臭氧通入KI溶液中,臭氧作为氧化剂,碘化钾被氧化生成碘单质,方程式为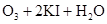 ===
===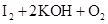 ;
;
(2)Na2S2O3溶液滴定到终点时,碘单质恰好反应完全,此时若加入淀粉作为指示剂,溶液颜色则有蓝色变为无色。
(3)根据这两个方程式: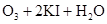 ===
===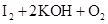 ;
; ,找出O3与Na2S2O3关系如下:
,找出O3与Na2S2O3关系如下:
O3————————————I2————————————2Na2S2O3
1mol? 2mol
n(O3)? 0.0100mol/L×0.0600L
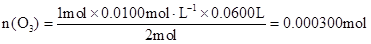
计算臭氧的体积分数是: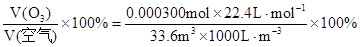 =
=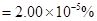
点评:氧化还原反应方程式的书写及中和滴定数据的处理是高中学生学习的一个难点,容易失分,本题属于中等题。
本题难度:一般
3、选择题 下列溶液中c(Cl-)最大的是( )
A.65mL1mol/L的KCl溶液
B.25mL3mol/L的NaCl溶液
C.20mL2mol/L的MgCl2溶液
D.10mL1.5mol/L的AlCl3溶液
参考答案:A、c(Cl-)=c(KCl)=1mol/L;
B、c(Cl-)=c(NaCl)=3mol/L;
C、c(Cl-)=2c(MgCl2)=4mol/L;?
D、c(Cl-)=3c(AlCl3)=4.5mol/L;
比较以上数据可知,浓度最大的为D,
故选:D
本题解析:
本题难度:一般
4、选择题 NA表示阿佛加德罗常数,下列说法正确的是
A.18gNH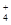 含有电子数为10NA
含有电子数为10NA
B.1mol任何气体的体积都约是22.4L
C.NA个H2SO4分子的质量等于H3PO4的摩尔质量
D.标准状况下,相同体积的O2、HCl、H2O含有的分子数相同
参考答案:A
本题解析:A.18gNH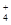 的物质的量为1mol,1molNH
的物质的量为1mol,1molNH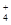 含有10mol电子,即10NA电子;B.标准状况下 1mol任何气体的体积都约是22.4L,故B错误;C.NA个H2SO4分子的质量在数值上等于H2SO4摩尔质量为98g,H3PO4的摩尔质量为 98g/mol,数值相同, 单位不同,故C错误;D.标准状况下,H2O为液体,不能用气体公式计算分子数,故D错误。
含有10mol电子,即10NA电子;B.标准状况下 1mol任何气体的体积都约是22.4L,故B错误;C.NA个H2SO4分子的质量在数值上等于H2SO4摩尔质量为98g,H3PO4的摩尔质量为 98g/mol,数值相同, 单位不同,故C错误;D.标准状况下,H2O为液体,不能用气体公式计算分子数,故D错误。
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为NA
B.标准状况下,1.8 g H2O所含有的质子数为NA
C.25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2NA
D.标准状况下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.2NA