微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法或关系式正确的是( )
A.在含有NaHCO3的溶液中:H+、K+、SO42-、Cl-能大量共存
B.c(H+)=10-12?mol?L-1的溶液中:K+、Ba2+、Cl-、Br-能大量共存
C.0.1mol/LCH3COONa溶液中:c(Na+)=c(CH3COO-)
D.0.1mol/L?NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
参考答案:A.NaHCO3的电离,NaHCO3═Na++HCO3-,HCO3-+H+═H2O+CO2↑,不能大量共存.故A错误;
B.在碱性溶液中,K+、Ba2+、Cl-、Br-能大量共存.故B正确;
C.因CH3COO-+H2O?CH3COOH+OH-,根据水解守恒c(Na+)=c(CH3COO-)+c(CH3COOH).故C错误;
D.NaHCO3的电离,NaHCO3═Na++HCO3-,HCO3-发生很弱的电离:HCO3-?H++CO32-,同时存在水解.因HCO3-部分发生了水解,HCO3-+H2O?H2CO3+OH-,HCO3-的浓度将减小,所以C(Na+)>C(HCO3-)水解比电离程度大,溶液呈碱性,C(OH-)>C(H+),C(OH-)>C(CO32-),因水解是微弱的,大部分仍以HCO3-存在,所以C(HCO3-)>C(OH-);故D正确;
故选B、D.
本题解析:
本题难度:简单
2、选择题 某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是
A.Na+、K+、Cl-、SO42-
B.Cu2+、Fe2+、NO3-、SO42-
C.Na+、Ca2+、Cl-、ClO-
D.K+、NH4+、Cl-、SO42-
参考答案:A
本题解析:加入铝粉产生大量氢气,故溶液可能含有大量H+,也可能含有大量OH-。由于题干强调“一定能大量共存”,即在大量H+和大量OH-条件下所选选项的离子组都能大量共存。故只有A满足条件。
本题难度:一般
3、填空题 (14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
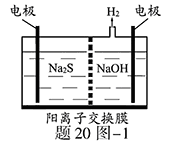
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S?(n—1)S+?S2-
S?(n—1)S+?S2- ?Sn2-
?Sn2-
①写出电解时阴极的电极反应式:?。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成?。
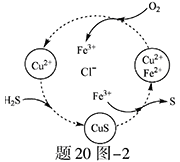
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是?。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为?。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有?。
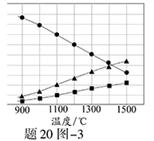
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为?。
参考答案:
(1)①? 2H2O+2e-=H2↑+2OH-
② Sn2-+2H+="(n-1)S↓+" H2 S↑
(2)①Cu、Cl?②0.5mol?③提高空气的比例(增加氧气的通入量)
(3)2H2S 2H2+S2
2H2+S2
本题解析:(1)阴极是水产生的氢离子放电;电解后生成Sn2-,与酸发生歧化反应反应生成硫单质和硫化氢;(2)根据电子守恒,硫化氢电子给了氧气,氧气得电子为0.5mol;增加铁离子含量,使硫化铜被充分氧化,所以需增加氧气使亚铁离子被充分氧化;(3)由图判断生成两种气体体积比为2:1,只能产生S2才符合题意。
本题难度:一般
4、选择题 下列各离子组在溶液中能共存且通入括号中相应气体后,仍能大量存在的是?
A.Na+、Ba2+、HSO3-、I-(氯气)
B.Ca2+、NO3-、Na+、Cl-(二氧化硫)
C.Fe3+、SO42-、CO32-、NO3- (氨气)
D.Na+、K+、HCO3-、Cl-(二氧化碳)
参考答案:D
本题解析:A、HSO3-、I-能被氯气氧化,不能存在,错误;B、NO3-能氧化亚硫酸(二氧化硫溶于水),不能存在,错误;C、Fe3+和CO32-不能大量共存,错误;D、正确。
本题难度:一般
5、选择题 下列各组离子,可以大量共存的是(?)
A.K+、NH4+、OHˉ
B.Na+、Ba2+、SO42ˉ
C.SO42-、Mg2+、NH4+
D.Clˉ、Fe3+ 、Ag+
参考答案:C
本题解析:?A、NH4+、OHˉ 反应生成NH3,A错;B、Ba2+、(SO4)2ˉ生成BaSO4沉淀,B错;C、正确;D、Clˉ、Ag+生成AgCl沉淀,D错;选C。
本题难度:一般