微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)现有失去标签的氯化钙,硝酸银,盐酸,碳酸钠四种无色溶液,为了确定四种溶液各是什么,将它们随意编号上A.B.C.D后,产生的现象如下表所示:
| 实验内容
| 实验现象
|
(1)
| A+B
| 没有现象发生
|
(2)
| B+D
| 有气体放出
|
(3 ) )
| B+C
| 有沉淀生成
|
(4)
| A+D
| 有沉淀生成
|
根据实验现象按要求回答:
(1)写出A.B.C.D溶液中溶质的化学式:
A______? B_______? C_____? D______
(2)写出上述实验中有关反应的离子方程式
实验(2) B+D ___________________? ?
?
实验(3) B+C __________________
参考答案:(12分)(1)A__CaCl2_ ?B__ HCl__? C__AgNO3 __? D_Na2CO3___
(2)实验(2) B+D ____ CO32-+2H+=H2O+CO2↑_________?
实验(3) B+C ________ Ag++Cl-="?" AgCl ↓________
本题解析:略
本题难度:一般
2、简答题 阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2.
(1)根据信息①,X一定不是______(填序号).
A氢?B.碳?C.氧?D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26.
(2)这四种元素中是否可能有一种是铝元素?______(填可能或不可能).
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀.
(3)白色沉淀物的化学式为______.
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀.
(4)生成白色沉淀物的离子方程式为______.
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为______.
参考答案:(1)X若为氢时,其最外层电子数为1,不合理;X若为硫,原子序数比X大的Y、Z、W不可能都是短周期元素,不合理,X为碳或氧时合理,故答案为:AD;
(2)Al具有②中元素的性质,四种元素可能有1种是铝元素,故答案为:可能;
(3)对所有短周期元素进行试探,唯有镁元素符合③中性质,可知白色沉淀物的化学式为Mg(OH)2,故答案为:Mg(OH)2;
(4)唯有硅元素在④变化中最终得到白色沉淀H2SiO3(或H4SiO4),生成该白色沉淀的离子方程式为SiO32-+2H+=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓),
故答案为:SiO32-+2H+=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓);
(5)已知X、Y、Z、W四种元素中的3种为Mg、Al、Si,只有X为碳时才符合X与W同主族且X原子序数最小的条件,X与浓H2SO4反应的化学方程式为C+2H2SO4(浓)?△?.??CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)?△?.??CO2↑+2SO2↑+2H2O.
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。
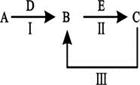
(1)若A为短周期常见金属单质,B、C均为含A元素的盐,且B溶液的pH>7,C溶液pH<7。用离子方程式表示B溶液pH>7的原因?;
(2)若A是淡黄色化合物;常温下D是无色气体;C为常见强碱,含有的阴、阳离子均为10电子粒子。
① C中所含化学键的类型是?;
②写出反应I的化学方程式?;
③将一定量的气体D通入2 L? C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为?,a点溶液中各离子浓度由大到小的顺序是?。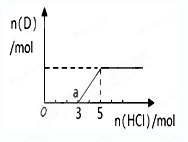
参考答案:(1)AlO2 - + 2H2O Al(OH)3 + OH -
Al(OH)3 + OH -
(2)①离子键和共价键?②2Na2O2+2CO2==2Na2CO3+O2
③NaOH和 Na2CO3?,?c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
本题解析:(1)根据已知条件可知,A是铝,D是氢氧化钠,B是偏铝酸钠,C是氯化铝,E是盐酸。膦甲酸钠由于AlO2-水解显碱性,方程式为AlO2 - + 2H2O Al(OH)3 + OH -。
Al(OH)3 + OH -。
(2)①淡黄色化合物是过氧化钠,即A是过氧化钠,则D是CO2,B是碳酸钠,C是氢氧化钠。氢氧化钠是含有离子键和极性键的离子化合物。
②过氧化钠和CO2反应的方程式为2Na2O2+2CO2==2Na2CO3+O2。
③由于碳酸钠和氯化氢反应是分布进行的,根据图像可知,生成CO2消耗的氯化氢小于o→a反应消耗的氢氧化钠,这说明o点含有的溶质是氢氧化钠和碳酸钠。A点恰好是碳酸氢钠,由于碳酸氢钠的水解程度大于电离程度,溶液显碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
本题难度:一般
4、填空题 (13分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X微粒含有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
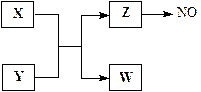
(1)Z →NO反应的化学方程式是:?
液态 Z的电离与水的电离相似,电离生成电子数相同的两种微粒,写出液态Z的电离方程式?。
(2)实验室中检验Z的化学试剂及现象是:
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2︰4︰3,该离子化合物是?(填写化学式),其0.1 mol/L的该溶液显酸性,则该溶液中离子浓度由大到小的顺序为?。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气两者的体积比是:?
参考答案:(13分)
(1)4NH3+5O2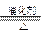 4NO+6H2O(2分)2NH3(l)
4NO+6H2O(2分)2NH3(l) NH2—+NH4+(2分)
NH2—+NH4+(2分)
(2)(每空1分计4分)
?
?化学试剂
?现象
方法一
湿润的红色石蕊试纸? (1分)
试纸变为蓝色 (1分)
方法二
蘸有浓盐酸(或浓硝酸)的玻璃棒 (1分)
有白烟生成? (1分)
(3)NH4NO3(1分)?c(NO3-)>c(NH4+)>c(H+)>c(OH-)(2分)
(4)2﹕3或 7﹕3(2分)
本题解析:略
本题难度:简单
5、简答题 在一定条件下可实现下图所示的物质之间的变化.明矾的主要成分是KAl(SO4)2?12H2O,孔雀石的主要成分是CuCO3?Cu(OH)2(碱式碳酸铜),受热易分解.其中B是两性氧化物,D是一种金属单质,F是一种气体,G是一种黑色金属氧化物.
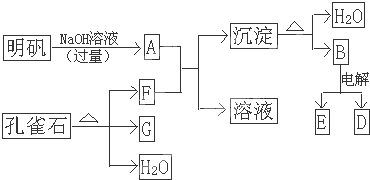
(1)写出A-G的化学式:
A是______;B是______;D是______;E是______;F是______;G是______.
(2)写出明矾溶液和过量NaOH溶液反应的离子方程式______;
(3)金属单质D可以跟黑色的金属氧化物G在高温下反应生成另一种金属单质,写出该反应的方程式______.
参考答案:明矾的主要成分是KAl(SO4)2?12H2O,与过量碱反应生成A,CuCO3?Cu(OH)2(碱式碳酸铜),受热易分解生成CuO、CO2、H2O,G是一种黑色金属氧化物,G为CuO,F是一种气体,A+F反应生成沉淀,则A为KAlO2,F为CO2,B是两性氧化物,B为Al2O3,B电解生成D,D是一种金属单质,则D为Al,E为O2,
(1)由上述分析可知,A为KAlO2,B为Al2O3,D为Al,E为O2,F为CO2,G为CuO,故答案为:KAlO2;Al2O3;Al;O2;CO2;CuO;
(2)明矾溶液和过量NaOH溶液反应的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(3)D可以跟黑色的金属氧化物G在高温下反应生成另一种金属单质为Cu,该反应为2Al+3CuO高温.Al2O3+3Cu,故答案为:2Al+3CuO高温.Al2O3+3Cu.
本题解析:
本题难度:一般