| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学基本概念》高频试题强化练习(2017年最新版)(六)
参考答案:A 本题解析:需要加入还原剂才能实现,则选项中各物质为氧化剂,发生还原反应,氧化剂中某元素的化合价降低,A.Ag+→Ag,银元素化合价由+1价降低到0价,加入铁发生置换反应就能实现,正确;B.CuO→ Cu,铜元素化合价由+2价降低到0价,但氢气还原氧化铜需加热,错误;C.SO2→SO3,S元素化合价由+4价升高到+6价 ,错误;D.CO→CO2碳元素化合价由+2价升高到+4价,错误;选A。 本题难度:一般 2、选择题 氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是 |
参考答案:D
本题解析:A、如果管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应生成HCl,HCl与NH3反应生成NH4Cl,现象为有白烟生成,正确;B、在3Cl2+2NH3=N2+6HCl反应中,Cl元素的化合价由0价降低为-1价,氯气表现出氧化性,正确;C、置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,3Cl2 + 2NH3 = N2 + 6HCl符合,正确;D、在3Cl2+2NH3=N2+6HCl反应中,N元素的化合价由-3价升高到0价,则生成1molN2有6mol电子转移,错误。
考点:考查氯气的化学性质,氧化还原反应。
本题难度:一般
3、填空题 (17分)(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO===Cu+H2O所属的区域。
② “四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为 反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式: 。
(2)已知反应:①SO3+H2O===H2SO4
②Cl2+H2O===HCl+HClO
③2F2+2H2O===4HF+O2
④2Na+2H2O===2NaOH+H2↑
⑤2Na2O2+2H2O===4NaOH+O2↑
⑥SiO2+2NaOH===Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号,下同);H2O被氧化的是 ,H2O被还原的是 ,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是 。
(3)反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素的化合价由 价变为 价,被 ; 元素的原子失去电子,被 ;若参加反应的HCl是73 g,则被氧化的HCl是 g。
(4)根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,
②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的( )
A.Fe3+>Cl2>I2
B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+
D.Cl2>Fe3+>I2
参考答案:(本题共17分)(每空1分)(1)①(1分)
②分解(1分) NaOH+HCl===NaCl+H2O(2分)
(2):①⑥(1分) ③(1分) ④ (1分)②⑤(1分)
(3):+7(1分) +2(1分) 还原(1分) Cl(1分) 氧化(1分) 45.625(2分)
(4) D(1分)
本题解析:(1)①H2+CuO===Cu+H2O该反应是置换反应,而置换反应一定是氧化还原反应,所以对应的区域在氧化还原反应的内部,如图: ;
;
②四种基本反应类型中,置换反应一定是氧化还原反应,化合、分解反应不一定是氧化还原反应,复分解反应一定不是氧化还原反应,所以B图中Ⅰ为化合反应,则Ⅱ为分解反应;III是复分解反应,如酸碱中和反应:NaOH+HCl===NaCl+H2O等;
(2)氧化还原反应的特征是元素在反应前后发生变化,6个反应中,①⑥反应中的各元素的化合价均未发生变化,所以不是氧化还原反应;H2O被氧化,因为H元素的化合价是+1价,是最高价,所以被氧化的元素是O元素,化合价升高为0价,③中的H2O被氧化,而⑤中也有氧气生成,但O2来自过氧化钠中的O元素,不是来自H2O,所以H2O被氧化的只有③;H2O被还原,则水中的H元素化合价降低,生成氢气,所以反应④中H2O被还原;其余两个都是氧化还原反应,但H2O既不被氧化,又不被还原,所以答案选②⑤;
(3)在反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价从+7价降低为+2价,化合价降低,被还原;失去电子的元素的化合价升高,所以Cl元素失去电子,化合价升高,被氧化;在该反应中,参加反应的HCl与被氧化的HCl的质量比是16:10=8:5,所以被氧化的HCl占参加反应HCl的5/8z,所以被氧化的HCl的质量是73g×5/8=45.625g;
(4)根据氧化剂的氧化性大于氧化产物的氧化性判断,①中的氧化剂是Fe3+,氧化产物是I2,所以氧化性Fe3+>I2;②中的氧化剂是氯气,氧化产物是Fe3+,所以氧化性Cl2>Fe3+,所以三者的氧化性的顺序是Cl2>Fe3+>I2,答案选D。
考点:考查四种基本反应类型与氧化还原反应的关系,氧化还原反应的分析,氧化性的比较
本题难度:一般
4、填空题 (6分)铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作________
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作________ _剂,具有 性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,生成 L SO2(标准状况)气体。
_剂,具有 性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,生成 L SO2(标准状况)气体。
参考答案:(6分)还原,还原,氧化,氧化,1 11.2
本题解析:略
本题难度:一般
5、选择题 在反应CuO+H2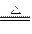 Cu+H2O中,作还原剂的是
Cu+H2O中,作还原剂的是
A.CuO
B.H2
C.Cu
D.H2O
参考答案:B
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《反应速率与.. | |