微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)
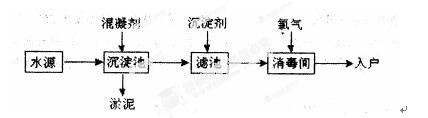
(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成?沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系??;
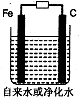
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为:?。
(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式:?。?
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式:?。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。
2、选择题 常温下,某未知溶液中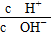 =1×1012,且含有大量Al3+和NO3—,检
=1×1012,且含有大量Al3+和NO3—,检
验此溶液中是否大量存在以下6种离子:①SiO32—、②NH4+、③Fe2+、④Na+、⑤HCO3—、⑥Cl-,其中不必检验就能加以否定的离子是( )
A.①③⑤
B.②③④
C.①②⑥
D.④⑤⑥
3、选择题 下列反应的离子方程式正确的是
A.FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+
B.钠和水反应:Na+H2O =Na++OH-+H2↑
C.硫酸溶液中滴加氢氧化钡溶液:Ba2++SO42-=BaSO4↓
D.向烧碱溶液中滴加盐酸:OH-+H+=H2O
4、填空题 I.常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。回答下列问题
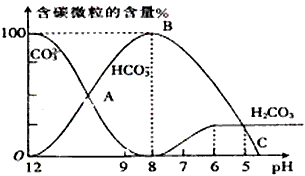
(1)H2CO3、HCO3-、CO32-中不能大量共存于同一溶液中的是___________________。
(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点……
指示剂B的变色范围在pH=______左右最理想。
(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是____________________。
(4)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=
2︰1时,溶液的pH=_____________。
II.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A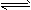 H++HA- HA-
H++HA- HA-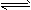 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol/L 的H2A溶液
(B)0.01mol/L 的NaHA溶液
(C)0.01mol/L 的HCl与0.04mol/L的NaHA溶液等体积混合液
(D)0.02mol/L 的NaOH与0.02 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号) :
(5)c(H+)最大的是_________,c(H2A)最大的是___________,c(A2-)最大的是_________。
5、填空题 (9分)1 L某混合溶液,可能含有的 离子如下表:
离子如下表:
可能大量含有的阳离子
| H+?NH4+ ?Al3+?K+
|
可能大量含有的阴离子
| Cl?- ?Br- ?I? ?ClO?AlO?2-
|
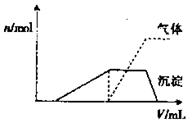
?(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(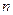 )与加NaOH溶液的体积(
)与加NaOH溶液的体积(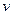 )的关系如右图所示。则该溶液中确定含有的离子有_______________;
)的关系如右图所示。则该溶液中确定含有的离子有_______________;
不能确定是否含有的阳离子有__________,要确定其存在可补充做的实验是________;
(2)经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该混合溶液中通入—定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的 关系如下表所示,分析后回答下列问题:
关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况)
| 2.8L
| 5.6 L
| 11.2 L
|
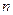 (Cl-) (Cl-)
| 1.25mol
| 1.5 mol
| 2 mol
|
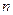 (Br-) (Br-)
| 1.5 mol
| 1.4 mol
| 0.9 mol
|
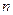 (I-) (I-)
|  ?mol ?mol
| 0
| 0
|
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为___?。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_____________。