微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各种环境下的离子组能大量共存的是
A.pH=1的溶液中:K+、Fe2+、Cl-、NO3-
B.强碱性溶液中:Na+、K+、[Al(OH)4]-、CO32-
C.中性溶液中:Na+、Ca2+、Cl-、SO42-
D.使蓝色石蕊试液变红的溶液中:SO32-、HCO3-、Na+、K+
参考答案:B
本题解析:
本题难度:简单
2、选择题 碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质.下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
A.能使紫色石蕊试液变蓝色
B.能与盐酸反应生成水
C.能与Na2S04溶液反应生成BaS04沉淀
D.能与CO2反应生成水
参考答案:A、碱均可以使紫色石蕊试液变蓝色,故A不选;
B、碱均可以和盐酸反应生成盐和水,故B不选;
C、能与Na2S04溶液反应生成BaS04沉淀的碱必须是符合复分解反应发生要求的碱,但是氢氧化钠等就不可以,故C选;
D、碱均可以与酸性氧化物CO2反应生成盐和水,故D不选.
故选C.
本题解析:
本题难度:简单
3、填空题 某混合溶液中可能大量含有的离子如下表所示:
阳离子
| H+、K+、Al3+、NH4+、Mg2+
|
阴离子
| Cl-、Br-、OH-、CO32-、AlO2-
|
?
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
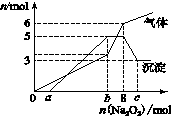
(1)该溶液中一定含有的阳离子是______________,其
对应物质的量浓度之比为________,溶液中一定不
存在的阴离子是_____________。
(2)请写出沉淀减少的离子方程式_____________________。
参考答案:(1)H+、Al3+、NH4+、Mg2+(2分);2:2:2:3(2分);OH-、CO32-、AlO2-(2分)
(2)Al(OH)3+OH-= AlO2-+2H2O(2分)
本题解析:(1)加入0~amol过氧化钠时,没沉淀生成,表明溶液中含有H+;从a~bmol沉淀量增加,从b~8mol沉淀粉的量不变,但是气体的量增加,表明一定含有NH4+;从8~cmol沉淀的量减少,表明溶液中一定含有Al3+;但是并没有溶解完,表明原溶液中还含Mg2+。因此含有的离子为:H+、Al3+、NH4+、Mg2+;溶解2mol的氢氧化铝需用氢氧化钠2mol,表明铝离子为2mol,那么镁离子为3mol,8mol的过氧化钠能生成16mol的氢氧化钠, b-a=12mol;16-2×3-3×2=4mol,也就是说,氢离子跟铵根离子总的物质的量为4mol。8mol的过氧化钠还生成4mol的氧气,因此氨气为2mol,那么铵根离子为:2mol,所以氢离子为2mol。所以:n(H+)﹕n(Al3+)﹕n(NH4+)﹕ n(Mg2+)= 2:2:2:3;溶液中一定不存在的离子是:OH-、CO32-、AlO2-。(2)Al(OH)3+OH-= AlO2-+2H2O(2分)
本题难度:一般
4、选择题 下列反应既是离子反应又是氧化还原反应的是
A.NaOH溶液和FeSO4溶液
B.AgNO3溶液和过量的NH3·H2O
C.Na2SO3溶液和酸性KMnO4溶液
D.Na2S溶液与稀H2SO4
参考答案:C
本题解析:四个反应皆为离子反应,但
A、FeSO4+2NaOH=Na2SO4+Fe(OH)2↓复分解反应,非氧化还原反应;
B、AgNO3+2NH3·H2O=[Ag(NH3)2]NO3+2H2O络合反应,非氧化还原反应;
C、5Na2SO3+2KMnO4+3H2SO4=5Na2SO4+K2SO4+2MnSO4+3H2O氧化还原反应;
D、Na2S+H2SO4=Na2SO4+H2S↑复分解反应,非氧化还原反应。
本题难度:一般
5、选择题 一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10—13mol·L—1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
参考答案:A
本题解析:A、含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-能大量共存;B、Ca2+、CO32-会生成CaCO3沉淀,不能大量共存;C、Fe3+与SCN-生成Fe(SCN)3,是络合物,Fe3+与SCN-不能大量共存;D、含有大量NO3-的溶液:H+、NO3-相当于硝酸,有氧化性,Fe2+不共存;选A
本题难度:困难