|
高中化学知识点讲解《有关氧化还原反应的计算》考点特训(2017年冲刺版)(八)
2017-08-22 17:15:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:
2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O。
则生成的盐溶液中NaNO2的物质的量为( )
A.0.4 mol
B.0.6 mol
C.0.8 mol
D.0.2 mol
|
参考答案:C
本题解析:反应中Cu-2e-
本题难度:一般
2、选择题 下列各项表达中,正确的是
A.水的电子式为
B.将58g等体积的乙烯和乙烷混合物完全燃烧,生成的二氧化碳体积为89.6L
C.所有的氮原子中,质子数都是7个,但不一定是相同的原子
D.氯离子的结构示意图为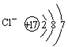
参考答案:C
本题解析:水是含有共价键的共价化合物,电子式是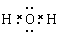 ,A不正确;乙烷和乙烯的相对分子质量不同,分别是30和28,在体积相等的条件下,58g混合气中二者的物质的量分别都是1mol,完全燃烧生成的CO2是4mol,但气体的状态不一定是在标准状况下,无法计算气体的体积,选项B不正确;氮元素有同位素,因此所有的氮原子中,质子数都是7个,但不一定是相同的原子,选项C正确;氯离子的最外层电子数是8个,选项D不正确,答案选C。 ,A不正确;乙烷和乙烯的相对分子质量不同,分别是30和28,在体积相等的条件下,58g混合气中二者的物质的量分别都是1mol,完全燃烧生成的CO2是4mol,但气体的状态不一定是在标准状况下,无法计算气体的体积,选项B不正确;氮元素有同位素,因此所有的氮原子中,质子数都是7个,但不一定是相同的原子,选项C正确;氯离子的最外层电子数是8个,选项D不正确,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:简单
3、填空题 (14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:
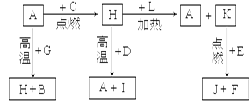
请回答下列问题:
(1)元素A在元素周期表中的位置为??周期??族。
(2)写出K的电子式??。
(3)写出H和D反应的化学方程式??。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式??。
(5)写出A与G反应的化学方程式??。
(6)K与E反应时产生的现象有?;该反应的化学方程式为? ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________
参考答案:(1)四;VIII ;(2)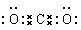 ;(3)3Fe3O4+8Al ;(3)3Fe3O4+8Al 4Al2O3+9Fe 4Al2O3+9Fe
(4)2Al+2OH-+2H2O==2AlO2-+3H2↑ (5)3Fe+4H2O(g) Fe3O4+4H2↑ Fe3O4+4H2↑
(6)镁带剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒;2Mg+CO2 2MgO+C 2MgO+C
(7) C(s)+ 1/2O2(g) CO (g) ΔH=-(a-b)kJ/mol; CO (g) ΔH=-(a-b)kJ/mol;
本题解析:根据题意及物质间的转化关系可得:A是Fe;B是H2;C是O2;D是Al;E是Mg;F是C;G是H2O;H是Fe3O4;I是Al2O3;J是MgO;K是CO2;L是CO。(1)26号元素Fe在元素周期表中位于第四周期第VIII族;(2)CO2的电子式是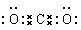 ;(3)Fe3O4和Al发生铝热反应的化学反应方程式是3Fe3O4+8Al ;(3)Fe3O4和Al发生铝热反应的化学反应方程式是3Fe3O4+8Al 4Al2O3+9Fe;(4)Al与氢氧化钠溶液反应的离子方程式是2Al+2OH- +2H2O= 2AlO2- +3H2↑;(5)炽热的Fe与水蒸气反应的化学方程式是3Fe+4H2O(g) 4Al2O3+9Fe;(4)Al与氢氧化钠溶液反应的离子方程式是2Al+2OH- +2H2O= 2AlO2- +3H2↑;(5)炽热的Fe与水蒸气反应的化学方程式是3Fe+4H2O(g) Fe3O4+4H2;(6)Mg带在CO2中能够着火剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒;反应的化学方程式为2Mg+CO2 Fe3O4+4H2;(6)Mg带在CO2中能够着火剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒;反应的化学方程式为2Mg+CO2 2MgO+C;(7)根据题意可得热化学方程式①C(s)+ O2(g) 2MgO+C;(7)根据题意可得热化学方程式①C(s)+ O2(g) CO2(g) ΔH="-akJ/mol;" ②CO(g)+ 1/2O2(g) CO2(g) ΔH="-akJ/mol;" ②CO(g)+ 1/2O2(g) CO2(g) ΔH="-bkJ/mol" bkJ/mol, ①-②整理可得:C(s)+ 1/2O2(g) CO2(g) ΔH="-bkJ/mol" bkJ/mol, ①-②整理可得:C(s)+ 1/2O2(g) CO (g) ΔH=-(a-b)kJ/mol; CO (g) ΔH=-(a-b)kJ/mol;
本题难度:一般
4、填空题 (5分)铜跟氯气在点燃条件下可发生反应:Cu + Cl2 ?= ?CuCl2。在该反应中,氯元素的化合价?(填“升高”或“降低”),被?(填“氧化”或“还原”,下同);Cl2作?剂,具有?性。若反应中消耗了1 mol Cu,则生成?mol CuCl2。
参考答案:降低?还原?氧化?氧化? 1
本题解析:略
本题难度:一般
5、填空题 (12分)硅孔雀石是一种含铜矿石,含铜形态为CuCO3、Cu(OH)2和CuSiO3?2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质。以其为原料制取硫酸铜的工艺流程如下图所示:
 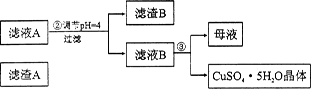
(1)步骤1中先加入足量稀硫酸,再加人双氧水。则双氧水参与该反应的离子方程式是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是________。(填字母编号)
A.A12O3 B.CuO C.CuCO3·Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| 开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
| 沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
|
则滤液B中含有的阳离子是__________________________。
(4)将滤液B通过_______、________、过滤等操作可得到硫酸铜晶体。
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是______________。取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol。则a=__________。(氧气占空气体积的五分之一)
参考答案:(1)2Fe2++H2O2+2H+=2Fe3++2H2O;(2)B、C;(3)Al3+、H+、Cu2+;
(4)蒸发浓缩、冷却结晶;(5)CuS+2O2 CuSO4;a= CuSO4;a=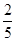 b-8。 b-8。
本题解析:(1)步骤1中先加入足量稀硫酸,可以使盐溶解,再加入双氧水,可以把溶液中Fe2+氧化为Fe3+。根据电子转移数目相等可知:双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;(2)步骤②调节溶液pH,应该既可以消耗溶液中H+,同时也不引入杂质离子,因此加入的物质应该是含有Cu元素的化合物,因此是CuO、CuCO3·Cu(OH)2,选项是B、C;(3)由于Al(OH)3沉淀完全的pH是5.2;Fe(OH)3沉淀完全的pH是3.7;Cu(OH)2沉淀完全的pH是6.7,而控制的溶液pH=4,所以滤液B中含有的阳离子是Al3+、H+、Cu2+;(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体。(5)用硫化铜和氧气在高温、催化剂条件下化合制得硫酸铜,根据元素原子守恒和电子守恒,可得该反应的化学方程式是CuS+2O2 CuSO4;n(O2)= CuSO4;n(O2)= ;n(CuS)= 384g÷96g/mol=4mol。假设发生反应产生n(CuO)=xmol;n(Cu2O)=ymol,则根据元素守恒可得:x+2y=4mol;3x/2+5y/2= ;n(CuS)= 384g÷96g/mol=4mol。假设发生反应产生n(CuO)=xmol;n(Cu2O)=ymol,则根据元素守恒可得:x+2y=4mol;3x/2+5y/2= 。(x+2y):(x+y)= 4:a。整理可得x=4b/5-20;y=12-2b/5;a= 。(x+2y):(x+y)= 4:a。整理可得x=4b/5-20;y=12-2b/5;a=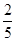 b-8。 b-8。
考点:考查离子方程式的书写、调整溶液pH的试剂的选用、溶液成分和混合物的成分的确定的知识。
本题难度:困难
|