|
高考化学知识点总结《热化学方程式》高频考点特训(2017年练习版)(十)
2017-08-22 17:15:44
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)=H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
A.4a+4b+4c
B.2a-2b+6c
C.2a-2b+2c
D.2a-6b+2c
|
参考答案:B
本题解析:解答本题时注意以下两点:
(1)室温时乙醇和水均为液态。
(2)运用盖斯定律对热化学方程式进行叠加。
本题难度:一般
2、填空题 氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
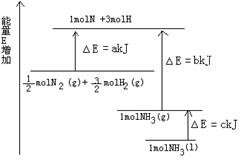
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是 。
(2)已知:①H2O(g)=H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q2 kJ/mol ③C2H5OH(g)=C2H5OH(l) ΔH=-Q3 kJ/mol
则23 g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为 kJ(请用Q1、Q2、Q3来表示 )
参考答案:(1)N2(g) +3H2(g)  2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3) 2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3)
本题解析:(1)根据图示可知:由反应物的能量与生成物的能量的关系可知N2与H2反应生成液态氨的热化学方程式是N2(g) +3H2(g)  2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ. 2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ.
考点:考查热化学方程式的书写及反应热的计算的知识。
本题难度:一般
3、简答题 过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式______:
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是______(填序号)
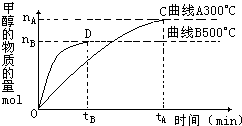
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= mol?(L?min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,增大
(3)25℃,1.01×105Pa时,16g?液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:______.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是______;正极的电极反应式:______.
参考答案:(1)根据K=生成物的浓度幂之积除以反应物的浓度幂之积,得出K=c(CH3OH)?c(H2O)c(CO2)?c3(H2),故答案为:K=c(CH3OH)?c(H2O)c(CO2)?c3(H2);
(2)A、化学反应速率等于单位时间内物质浓度的变化量,甲醇的平均反应速率v(CH3OH)=nA2tAmol?(L?min)-1,故A错误;
B、根据图示信息:升高温度,甲醇的物质的量减少,所以反应逆向进行,即反应是放热反应,对于放热反应,升高温度,平衡常数减小,故B错误;
C、根据图示信息:升高温度,甲醇的物质的量减少,所以反应逆向进行,即反应是放热反应,故C正确;
D、C点时反应达到平衡状态,升高温度,对于该放热反应,平衡逆向进行,所以n(H2)n(CH3OH)增大,故D正确;
故选CD.
(3)16g?液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,则1mol?液态甲醇完全燃烧,当恢复到原状态时,放出725.8kJ的热量,即热化学方程式为:
CH3OH(l)+32?O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol,故答案为:CH3OH(l)+32?O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(4)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子得还原反应,根据所给试剂,只能选择氢氧化钠为电解质,在碱性环境下,氧气的放电情况为:O2+2H2O+4e-=4OH-,故答案为:甲醇;O2+2H2O+4e-=4OH-.
本题解析:
本题难度:一般
4、简答题 (1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l)
△H/(kJ?mol-1)
-283.0
-285.8
-726.5
|
请回答下列问题:
①该条件下CH3OH(l)完全燃烧的热化学方程式为:______.
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)═CH3OH(l)△H=______.
(2)①常温下,0.10mol/LNH4Cl溶液pH______7(填>、=、<),溶液中各离子浓度由大到小的顺序是______.
②相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小关系是Na2S______NaHS(填>、=、<),两种溶液中微粒种类:Na2S______NaHS(填>、=、<).
参考答案:(1)①燃烧热的概念:在25℃、101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.此时S应转化为SO2,C应转化为二氧化碳,H应转化为液态水.
故△H═-726.5kJ?mol-1指的是1molCH3OH(l)完全燃烧生成二氧化碳和液态水时的反应热,
故CH3OH(l)完全燃烧的热化学方程式:CH3OH(l)+32O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ?mol-1
故答案为:CH3OH(l)+32O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ?mol-1;
②CO燃烧的热化学方程式:CO(g)+12O2(g)═CO2(g)△H=-283.0kJ?mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ?mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+32O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ?mol-1 ③
将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-128.1KJ?mol-1
故答案为:-128.1KJ?mol-1;
(3)NH4+水解生成NH3?H2O和H+,呈酸性,则溶液中c(H+)>c(OH-),c(Cl-)>c(NH4+),由于水解程度较小,则c(NH4+)>c(H+),则离子大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:<;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)Na2S以第一步水解,Na2S的水解程度大于NaHS,所以Na2S的PH大于NaHS,溶液中还存在HS-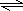 H++S2-,所以两种溶液中微粒种类相同, H++S2-,所以两种溶液中微粒种类相同,
故答案为:>;=.
本题解析:
本题难度:一般
5、填空题 (共17分).Ⅰ(11分)、一无色透明的溶液做如下实验:
参考答案:
本题解析:
本题难度:困难
|