______
______
假设______成立
______
假设______成立
参考答案:(1)反应前后各元素化合价不变的化学反应是非氧化还原反应,A中各元素在反应前后没有化合价的变化,所以是非氧化还原反应,故选A;
(2)B反应中,双氧水中氧元素失电子化合价升高作还原剂,所以体现还原性,故选B;
(3)C反应中,双氧水中的氧元素既有化合价的升高又有化合价的降低,所以既体现氧化性又体现还原性,故选C;
(4)A体现双氧水有酸性,它是二元弱酸,故选A;
(5)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,故氧化性顺序为:Ag2O>H2O2>K2CrO4,故答案为:Ag2O>H2O2>K2CrO4;
(6)双氧水的还原产物为水,对环境无污染,所以是绿色氧化剂,故答案为:还原产物通常为水,对环境无污染;
(7)一个双氧水分子参加氧化还原反应时得2个电子,一个亚铁离子参加氧化还原反应失去一个电子,所以得失电子的最小公倍数是2,则双氧水的计量数是1,亚铁离子的计量数是2,然后根据原子守恒配平其它原子,所以该反应是
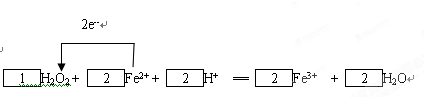
,
故答案为:
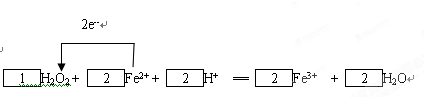
;
(8)(A)通过题意知,双氧水有强氧化性和酸性,所以提出的两种假设为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化,
故答案为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况,如果溶液又变红色,则假设①成立;如果溶液颜色无变化,则假设②成立,
故答案为:
简单实验方案预测的实验现象结论向褪色后的溶液中再加入过量NaOH溶液溶液又变红色①溶液颜色无变化(依然为无色)②
本题解析:
本题难度:一般
2、简答题 某一反应体系中,有反应物和生成物共五种物质,这五种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物.
(1)该反应中的氧化剂是______,氧化产物为______.
(2)该反应中,氧化产物与还原产物的物质的量之比为______.
(3)若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为______NA
(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为______g.
(4)购买的浓盐酸(密度为1.19g/cm3)在工业上是用HCl气体(标准状况)与H2O按体积比500:1配制成的,则该盐酸的物质的量浓度是______mol/L(结果保留一位小数).
参考答案:(1)高锰酸钾中的锰元素处于最高价,只有氧化性,能将HCl氧化,HCl是还原剂,对应的产物Cl2是氧化产物,故答案为:KMnO4;?Cl2
(2)根据电子守恒配平高锰酸钾氧化HCl的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,氧化产物是氯气,还原产物是MnCl2,物质的量之比为5:2,故答案为:5:2;?
(3)根据化学方程式:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,当生成5mol的氯气时,消耗高锰酸钾2mol,转移电子10mol,当产生的气体在标准状况下体积为2.24L,即生成氯气是0.1mol时,消耗高锰酸钾0.04mol,则反应过程中转移电子0.2mol,即0.2NA个,发生反应的KMnO4的质量为0.04mol×158g/mol=6.32g,故答案为:0.2;6.32g;
(4)盐酸的w%=500L22.4L/mol×36.5g/mol500L22.4L/mol×36.5g/mol+?1000g×100%≈44.9%,根据c=nV=mMV=m溶质Mm溶液ρ=1000ρw%M=1000×1.19×44.9%36.5≈14.6(mol/L).
故答案为:14.6.
本题解析:
本题难度:一般
3、填空题 分析下列氧化还原反应中化合价变化的关系,用双线桥法标出电子转移的方向和数目,并指出氧化剂和还原剂.
(1)Fe+H2S04=FeS04+H2↑;氧化剂是______;还原剂______.
(2)C+H2O(g) =CO+H2↑;催化剂是______;还原剂______.
参考答案:(1)该反应中,铁失电子化合价升高,硫酸得电子化合价降低,所以铁是还原剂,硫酸是氧化剂,转移电子数为2e-,
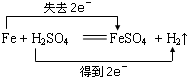
;
故答案为:硫酸,铁;
(2)该反应中碳失电子化合价升高,水得电子化合价降低,所以水是氧化剂,碳是还原剂,转移电子数是2e-,
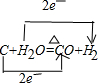
;
故答案为:水,碳.
本题解析:
本题难度:一般
4、填空题 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中
(1)______是还原剂,______是还原产物.
(2)该反应的离子方程式为:______.
(3)用双线桥法分析此氧化还原反应 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O______
(4)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L,则反应过程中转移电子的数目为______,被氧化的HCl的质量为______g.
参考答案:在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高,
(1)该反应中HCl为还原剂,KMnO4为氧化剂,则MnCl2为还原产物,故答案为:HCl;MnCl2;
(2)在离子反应中,气体和水应保留化学式,该反应的离子反应为MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案为:MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)该反应中Mn得到2×5e-,Cl失去10×e-,则双线桥法表示反应转移的电子的方向和数目为
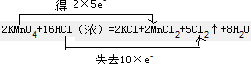
,
故答案为:

;
(4)若产生标准状况下的气体的体积为2.24L,n(Cl2)=2.24L22.4L/mol=0.1mol,反应过程中转移电子的数目为0.1mol×2×1×NA=0.2NA,被氧化的HCl的物质的量为0.2mol,则被氧化的HCl的质量为0.2mol×36.5g/mol=7.3g,故答案为:0.2NA;7.3.
本题解析:
本题难度:简单
5、选择题 已知高氯酸铵是火箭的一种燃料,加热时发生反应:NH4ClO4→N2↑+H2O↑+Cl2↑+O2↑(方程式未配平),该反应放出大量的热.下列有关叙述不正确的是( )
A.该反应的氧化产物只有氮气
B.该反应是一个焓减和熵增的过程
C.该反应中被还原的元素位于元素周期表中第三周期第VIIA族
D.该反应属于分解反应,又属于氧化还原反应
参考答案:A、化合价升高的有氮元素、氧元素,氧化产物为氮气和氧气,故A错误;
B、反应是放热反应,生成的物质能量低于反应物的能量,故是焓减小的反应,反应是气体体积增大的反应,是熵增大的反应,故B正确;
C、被还原的元素为氯元素,位于元素周期表中第三周期第VIIA族,故C正确;
D、该反应符合分解反应概念,又符合氧化还原反应概念,故D正确;
故选A.
本题解析:
本题难度:一般
|