微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 储氢纳米碳管的研制成功体出了科技的进步.用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种.
(1)请用上述物质填空,并配平化学方程式:
______?C+______+______?H2SO4═______+______+______Cr2(SO4)3+______?H2O
(2)上述反应中氧化剂是______(填化学式),被氧化的元素______(填元素符号).
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)______.
A.氧化性?B.氧化性和酸性
C.酸性?D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______.
参考答案:(1)由C-→CO2、K2Cr2O7-→Cr2(SO4)3变化过程中得失电子守恒和反应的部分化学方程式可配平得3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,
故答案为:3;2K2Cr2O7;8;3CO2;2K2SO4;2;8;
(2)分析所给物质的化合价氧化剂为K2Cr2O7,还原产物为Cr2(SO4)3,还原剂为C,氧化产物为CO2.故答案为:K2Cr2O7;C;
(3)H2SO4在反应中各元素的化合价没有发生变化,只表现酸性.故答案为:C;
(3)设产生的气体的体积为V,根据反应式计算:
? 3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O? 转移电子
? 33.6L?12mol?
? V? 0.8mol
V=0.8?mol×33.6?L/mol÷12=4.48?L.故答案为:4.48?L.
本题解析:
本题难度:一般
2、选择题 已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
A.KClO3是氧化剂
B.3molCl2生成时有10mol电子转移
C.H2SO4既不是氧化剂又不是还原剂
D.被氧化与被还原的氯元素的质量比为5:1
参考答案:B
本题解析:解析:由5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O可知,KCl中Cl元素由-1价升高为0,KClO3中Cl元素由+5价降低为0,
A.含元素化合价降低的物质为氧化剂,则KClO3是氧化剂,故A正确;
B.由反应可知,3molCl2生成时有5mol电子转移,故B错误;
C.H2SO4中各元素的化合价在反应前后不变,则H2SO4既不是氧化剂又不是还原剂,故C正确;
D.KCl为还原剂,被氧化,KClO3是氧化剂被还原,则被氧化与被还原的氯元素的质量比为5:1,故D正确;
所以答案选B
本题难度:一般
3、填空题 黑火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S═K2S+N2↑+3CO2↑.其中被还原的元素是______,还原剂是______.若有1.6g?S参加反应,则反应中电子转移的总数为______.
参考答案:2KNO3+3C+S═K2S+N2↑+3CO2↑中,硫元素的化合价由0价→-2价,得电子被还原,N元素的化合价由+5价→0价,得电子被还原,C元素的化合价由0价→+4价,失电子作还原剂,有32g硫参加反应时,转移电子个数是12 NA,当有有1.6g?S参加反应,则反应中电子转移的总数为0.6NA,
故答案为:N、S;C;0.6NA.
本题解析:
本题难度:一般
4、填空题 I.根据下列化学方程式回答问题:
SiO2+2C+2Cl
?SiCl4+2CO
(1)12gC参与反应时电子转移的数目是______.(2)在该反应中,氧化剂是______.
II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式______.
(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式______.
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带海带灰浸泡液I2(CCL4)→I2
从A~C中选择适当的装置填空(填字母):
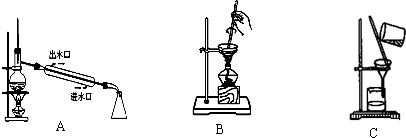
(1)过滤操作时用到的装置是______.
(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置______.
参考答案:I.(1)12gC是1mol,碳由0价升高到+2价,故电子转移的数目是2NA;氧化剂是化合价降低的物质,Cl2的化合价降低,故答案为:2NA;Cl2 ;
II.(1)铜与氯化铁溶液反应生成2FeCl2和CuCl2,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)根据铝热法冶炼金属的原理:金属氧化物与铝反应得到金属和氧化铝,所以铝和MnO2反应的化学方程式为4Al+3MnO2?高温?.? 2Al2O3+3Mn,
故答案为:4Al+3MnO2?高温?.? 2Al2O3+3Mn;
III.(1)根据图形判断,C是过滤实验装置实验,故答案为:C;
(2)因CCl4易挥发,可用蒸馏的方法分离出CCl4,故答案为:A.
本题解析:
本题难度:一般
5、填空题 水是生命之源,也是化学反应中的主角.试回答下列问题:
A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
(1)______;
(2)______;
(3)______.
参考答案:中学化学中常见由短周期元素组成的有色物质,且它们均能与水发生氧化还原反应但水既不是氧化剂也不是还原剂的是有Cl2、NO2、Na2O2.
(1)NO2与水反应生成NO和HNO3,化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO.
(2)Cl2与水反应生成HCl和HClO,化学方程式为Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(3)Na2O2和水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑.
本题解析:
本题难度:简单