微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在粗盐提纯的实验中,蒸发时正确的操作是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热
D.蒸发皿中出现大量固体时即停止加热
参考答案:D
本题解析:
本题难度:一般
2、选择题 除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是?(?)
?
| 混合物
| 试剂
| 分离方法
|
A
| CO2(HCl)
| 饱和Na2CO3溶液
| 洗气
|
B
| 乙烷(乙烯)
| 氢气
| 加热
|
C
| 溴(水)
| 乙醇
| 蒸馏
|
D
| 乙醇(水)
| 新制生石灰
| 蒸馏
参考答案:D
本题解析:A不正确,CO2也能被饱和碳酸钠溶液吸收,应该用饱和的碳酸氢钠溶液;B不正确,应该用溴水;C不正确,乙醇和水互溶,应该用四氯化碳或苯,答案选D。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。有利于培养学生的逻辑推理能力和规范实验设计能力。该题需要注意的是在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
3、实验题 乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇,和普通汽油按一定比例混配形成的新型替代能源。有人指出,近年来冬季北方路面经常结冰,是由于大量使用乙醇汽油,而乙醇燃烧时,会产生比普通汽油更多的水的原因导致的。某校研究性学习小组设计了如下实验,测定学校附近加油站的93号汽油中乙醇的含量,并比较乙醇燃烧与普通汽油燃烧产生水的量。
甲同学认为,分离互溶的液体混合物最好的方法就是蒸馏,只要通过蒸馏并收集乙醇汽油中的乙醇就可以计算其含量。于是,他设计了按下图装置进行的蒸馏实验,
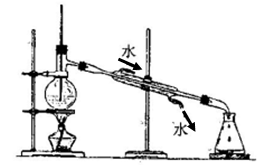
⑴请找出上图装置中的两处错误:?,?。
经查阅相关资料得到乙醇及普通汽油主要成分(5—11碳的烷烃)的沸点如下表:
有机物
| 乙醇
| 戊烷
| 己烷
| 庚烷
| 辛烷
| 壬烷
| 癸烷
| 十一烷
| 沸点/℃
| 78.4
| 36.1
| 68.7
| 98.5
| 125.8
| 150.8
| 174.1
| 195.6
|
⑵乙同学根据上表中的数据提出,甲同学的方案不易实施,得不到纯净的乙醇,请简述其中的原因:?。
⑶乙同学根据查阅的资料提出:可以用水萃取乙醇汽油中的乙醇,以此实现分离乙醇的目的。向分液漏斗中加入乙醇汽油和蒸馏水,如想使乙醇全部进入水层需要进行的操作是:?;静置分层后普通汽油在?层(填“上”或“下”)。通过测定普通汽油的质量与原乙醇汽油的质量就可计算出乙醇的质量分数。
⑷燃烧时产生水的多少是由有机物的含氢量(氢元素的质量分数)决定的,根据上表中普通汽油的成分可知,普通汽油中含氢量最高的是:?(填分子式)、最低的是:?(填分子式);则等质量的乙醇与这两种有机物相比较,完全燃烧时产生水的质量最小的
是:?(填分子式)。
参考答案:⑴温度计插入液面下,冷凝水流动方向反了。(各2分)
⑵由于蒸馏要求物质间沸点差异较大(一般大于30℃),而表中显示,己烷与乙醇沸点接近,故此不能得到纯净的乙醇。 (2分)
⑶振荡(2分),上(1分)。?⑷C5H12,C11H24,C2H6O(各2分)
本题解析:(1)蒸馏时温度计测量的是气体的温度,所以温度计的水银球应该放在支管出口处。冷凝时水流的方向和气体的方向应该是相反的。
(2)根据表中数据可知己烷与乙醇沸点接近,所以不能通过蒸馏得到乙醇。
(3)要使萃取的更彻底,应该震荡,使其充分接触。汽油的密度小于水的,在上层。
(4)烃分子最简式CHn可知,n越大,含氢量越高,所以含氢量最高的是C5H12,最低的是C11H24。由于乙醇中含氢量最低,所以乙醇完全燃烧生成的水的质量最小。
本题难度:一般
4、选择题 配制一定体积一定物质的量浓度溶液时,下列情况对实验结果产生偏高影响的是
A.定容时仰视刻度线
B.容量瓶中还有蒸馏水时即配溶液
C.定容时液面高于刻度,用滴管小心吸去多余液体,使液面与刻度相切
D.定容时俯视刻度线
参考答案:D
本题解析:
本题难度:简单
5、选择题 一定质量的某硝酸钾样品中不含可溶性杂质,在10℃时加一定量蒸馏水使之充分溶解,残留固体的质量为250g,若升温至40℃,残留固体的质量为120g;升温至70℃,残留固体的质量为20g.已知KNO3在不同温度下的溶解度:
A.该硝酸钾样品一定为纯净物
B.40℃时溶于水的硝酸钾为130g
C.70℃硝酸钾溶液为饱和溶液
D.55℃左右时硝酸钾完全溶解
参考答案:D
本题解析:分析:根据硝酸钾不同温度下的溶解度差值,利用已知温度段10℃到40℃的硝酸钾的溶解量增加值计算温度段40℃到70℃的溶解度增加值,与题目中实际增加值比较,可知道70℃硝酸钾溶液还未达到饱和,存在杂质,杂质质量为20g,通过40℃到55℃溶解度增加值,算出55℃左右硝酸钾恰好完全溶解.
解答:A.从10℃到40℃,硝酸钾溶解度增大了45g,溶解的硝酸钾增加了250-120=130 g,从40℃到70℃,硝酸钾的溶解度增大了140g-65g=75g,
硝酸钾达到饱和需要的溶解量为130÷45×75=216.67g,溶解的硝酸钾增加了120-20=100 g,小于216.67g,说明硝酸钾已经溶解完毕,残余固体为杂质,故A错误;
B.从10℃到40℃,溶解的硝酸钾增加了250-120=130 g,10℃时已有部分硝酸钾溶解,故40℃时溶于水的硝酸钾为大于130g,故B错误;
C.从A选项分析可以知道,70℃时硝酸钾达到饱和需要多加216.67-100=116.7g硝酸钾,故此时不为饱和溶液,故C错误;
D.从10℃到40℃,硝酸钾溶解度增大了45,溶解的硝酸钾增加了250-120=130 g,从40℃到55℃,硝酸钾的溶解度增大了100-65=35,硝酸钾达到饱和需要的溶解量130÷45×35=101.11g,近似等于120-20=100g,故从10℃到40℃,硝酸钾溶解度增大了45,溶解的硝酸钾增加了250-120=130 g,从40℃到70℃,硝酸钾的溶解度增大了140-65=75,硝酸钾达到饱和需要的溶解量,D正确;
故选D.
点评:本题考查了硝酸钾在不同温度下的溶解度,根据溶解度差值计算增加的硝酸钾质量,判断硝酸钾是否饱和、什么时候溶解完全、是否含有杂质等即可解答.
本题难度:简单
|