微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])与pH的变化关系如图所示,则
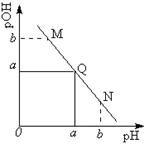
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO-)﹥c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
参考答案:C
本题解析:开始时溶液呈酸性,pH较小,溶液中的溶质为醋酸,当加入少量氢氧化钠溶液的M点,溶液中的溶质为醋酸和少量的醋酸钠;Q点时溶液中有较多的醋酸钠和少量的醋酸,由于醋酸是弱电解质,故Q点的导电能力强于M点,A错;N点溶液中溶质为醋酸钠和过量的氢氧化钠,此时溶液显碱性,溶液中c(CH3COO-)<c(Na+),B错;M点时,pOH=b,则溶液中的[OH-]=10-bmol/L,由于溶液显酸性,溶液中电离的水为:10-bmol/L,N点时,pH=b,则溶液中的[H+]=10-bmol/L,由于溶液显碱性,溶液中电离的水为:10-bmol/L,水的电离程度相同,C对;由于醋酸和氢氧化钠等浓度,等体积混合时,两者恰好完全反应,溶液中的溶质为醋酸钠,溶液显碱性;但是Q点pOH=pH时,溶液恰好呈中性,不符合,D错。
【考点定位】此题考查了电解质之间的反应、溶液的pH、水的电离等知识和考生对新信息的理解能力。
本题难度:简单
2、选择题 下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5
C.离子化合物中不可能存在共价键
D.金属元素与非金属元素形成的化合物一定是离子化合物
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列说法正确的是
A.氢键是一种特殊的化学键
B.分子晶体中一定存在共价键
C.离子晶体在常温下均为固态
D.原子晶体中不一定存在共价键
参考答案:C
本题解析:
本题难度:困难
4、选择题 能用分液漏斗分离的是
A.苯和苯酚
B.溴苯和水
C.乙醇和溴水
D.乙醇和乙酸
参考答案:B
本题解析:分析:只有当两种物质互不相溶时,才能用分液漏斗分离,结合有机物的水溶性进行判断.
解答:A.苯和苯酚互溶,不能用分液的方法分离,故A错误;
B.溴苯和水互不相溶,可用分液的方法分离,故B正确;
C.乙醇和溴水互溶,不能用分液的方法分离,故C错误;
D.乙醇和乙酸互溶,不能用分液的方法分离,故D错误.
故选:B.
点评:本题考查有机物的性质以及物质的分离方法,题目难度不大,本题注意把握常见有机物的物理性质以及分离方法.
本题难度:困难
5、选择题 X、Y、Z为同周期的三种元素。已知它们最高价氧化物的水化物的酸性由强到弱顺序为HXO4>H2YO4>H3ZO4,则下列判断正确的是
A.非金属性XB.原子半径X>Y>Z
C.气态氢化物的稳定性X>Y>Z
D.原子最外层电子数X
参考答案:C
本题解析:最高价氧化物的水化物的酸性越强,对应的元素非金属性越强;所以A错,非金属性为X>Y>Z;B错,同周期从左到右元素原子半径逐渐减小,且非金属性越强;原子半径的关系为:X<Y<Z;C正确,氢化物的稳定性与非金属性有关,非金属性越强氢化物越稳定;D错,同周期非金属越强,易得电子,最外层电子数越多,即最外层电子数X>Y>Z;
本题难度:困难