微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是 ,可能有的阳离子是 。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是 ,可能含有的阳离子是 。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为 。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为 。
参考答案:(1)Fe2+ Cu2+
(2)Cu2+ Fe2+或H+
(3)9.6 g
(4)7.2 g
本题解析:本题中要注意的是稀HNO3将铁和铜氧化时的反应顺序:①与Fe反应生成Fe3+;②与Cu反应生成Cu2+;③Fe3+与Fe反应生成Fe2+。(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是Fe2+,可能有的阳离子是Cu2+;(2)若反应后有Fe3+,则此溶液中一定有的阳离子是Cu2+,可能有的阳离子是Fe2+或H+,而这两者不能同时大量存在;(3)由上述的三个过程可知,只发生与铜的反应时所需的金属质量是最大的,由3Cu~8HNO3可解得需Cu的质量最大为9.6 g;(4)因要求金属质量要最小,所以加入的铁要尽量多地耗酸,所以生成的是Fe3+,加入的Fe与Cu的质量比为7∶8,得到两者的物质的量之比为1∶1,根据Fe~4HNO3,3Cu~8HNO3可解得需金属的物质的量各为0.06 mol,从而可得金属的质量为7.2 g。
本题难度:一般
2、选择题 下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是
A.2F2+2H2O=4HF+O2
B.2Na+2H2O=2NaOH+H2↑
C.C12+H2O=HC1O+HC1
D.C+H2O CO+H2
CO+H2
参考答案:C
本题解析:水既不做氧化剂,又不做还原剂的是反应前后化合价不变的,因此选C。
本题难度:简单
3、选择题 下列对应微粒的电子式书写正确的是( ? )
A.钾离子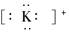
B.氦原子He∶
C.氯离子Cl-
D.锂原子·Li∶
参考答案:B
本题解析:钾离子:K+;氯离子: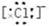 ;锂原子Li·
;锂原子Li·
本题难度:简单
4、选择题 某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。已知0.1mol KBrO3在反应中得到0.5mol电子生成X,则下列说法错误的是
A.氧化产物与还原产物的计量系数之比为5:2
B.氧化性:KBrO3>H3AsO4
C.AsH3中As元素被氧化,发生氧化反应
D.X的化学式为Br2
参考答案:A
本题解析:略
本题难度:一般
5、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式: ;
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;在下面的化学式上标出电子转移的方向和数目2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+ Na2SO4 + 2 H2O
参考答案:(1)2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑+ Cl2↑+ 2 H2O
(2)H2O2, 2.24 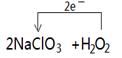
(3)4:1
本题解析:(1)方法一中的反应只有钠离子和一半的氯离子实际不参加反应,则离子反应为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,
(2)2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+2Na2SO4+2H2O中,O元素的化合价升高,则H2O2为还原剂被氧化,Cl元素的化合价由+5价降低为+4价,转移1个电子,反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故答案为:H2O2;2.24;
单线桥法标出电子转移的方向和数目。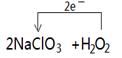
考点:考查离子反应及氧化还原反应
本题难度:一般