微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 有一无色溶液,可能含有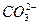 、
、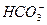 、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
参考答案:原无色溶液中肯定存在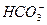 ?现象是溶液中逸出无色、无味气体
?现象是溶液中逸出无色、无味气体
本题解析:向原溶液中滴加过量的BaCl2溶液未见明显现象,说明溶液中肯定不含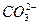 。以后的实验,化学原理用离子方程式表示为:
。以后的实验,化学原理用离子方程式表示为:
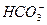 +OH-+Ba2+====BaCO3↓+H2O
+OH-+Ba2+====BaCO3↓+H2O
BaCO3+2H+====CO2↑+Ba2++H2O
CO2+Ca2++2OH-====CaCO3↓+H2O
由此可知,原无色溶液中肯定存在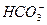 ;
;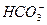 +H+====CO2↑+H2O
+H+====CO2↑+H2O
现象是溶液中逸出无色、无味气体。
本题难度:简单
2、计算题
NaNO3?KNO3?NaCl? KCl
10℃? 80.5? 20.9? 35.7? 31.0
100℃? 175? 246? 39.1? 56.6
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取23.4 g NaCl和40.4 g KNO3,加70.0 g H2O,加热溶解。在100℃时蒸发掉 50.0 g H2O,维持该温度,过滤析出晶体,计算所得晶体的质量(m高温)。
将滤液冷却至10 ℃,待充分结晶后过滤。计算所得晶体的质量(m低温)。
(2)另取34.0gNaNO3和29.8 g KCl,同样进行如上实验。10℃时析出的晶体是_______________(写化学式)。100℃和10℃得到的晶体质量(m′高温和m′低温)分别是多少?
参考答案:(1)15.6 g? 36.9 g ?(2)15.6 g? 36.9 g
本题解析:(1)100℃时S (NaCl)最小,所以析出NaCl晶体,则不析出KCl、NaNO3;KNO3溶液未达饱和,亦不会析出。
m高温=23.4 g-39.1 g×(70.0 g-50.0 g)÷100 g
=23.4 g-7.82 g
=15.6 g
将溶液冷却到10℃,析出晶体为KNO3和NaCl,析出KNO3晶体质量为:
40.4 g-20.9 g×(70.0g-50.0 g)÷100 g
=40.4 g-4.18 g
="36.2" g
析出NaCl晶体的质量为:(39.1 g-35.7 g)×(70.0 g-50.0 g)÷100 g="0.68" g
则:m低温="0.68" g+36.2 g="36.9" g
(2)两种原始溶液中,各种盐的物质的量都相等。
n(NaCl)=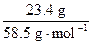 =n(KNO3)=
=n(KNO3)=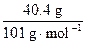 =n(NaNO3)
=n(NaNO3)
=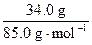 =n(KCl)=
=n(KCl)=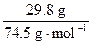 ="0.400" mol。
="0.400" mol。
因而溶解后得到的两种溶液中四种离子浓度完全相同,根据溶解度数据可知,100℃时蒸发后得到的是NaCl晶体,冷却后得到的是KNO3晶体,但也含有少量的NaCl。所以第(2)小题不必再计算,便知:
m′高温=m高温="15.6" g ?m′低温=m低温="36.9" g
本题难度:简单
3、选择题 下列电离方程式书写正确的是
A.H2SO4==H2++SO42--
B.MgCl2==Mg2++Cl2--
C.NaNO3==Na++NO3--
D.HClO==H++Cl--?+O2--
参考答案:C
本题解析:试题分析:A不正确,应该是H2SO4===2H++SO42-;B不正确,应该是MgCl2==Mg2++2Cl--;D不正确,应该是HClO H++ClO--,答案选C。
H++ClO--,答案选C。
考点:考查电离方程式的正误判断
点评:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式。书写电离方程式时应特别注意:
①写出物质正确的化学式是正确书写电离方程式的基础。
②要正确书写出电离的阳离子、阴离子的符号。这里注意区分离子符号和化合价的书写。离子所带电荷的数目应标在元素符号的右上角,且要先写数字,后写“+”或“-”号;化合价标在元素符号的正上方,先写“+”或“-”号,后写数字。离子的电荷数为1时,1省略不写,只写“+”或“-”号;而化合价数为1时,1必须标明。
③含有原子团的物质电离时,原子团应作为一个整体,不能分开。
④表示离子数目的数字要写在离子符号的前面,不能像在化学式里那样写在右下角。
⑤在电离方程式中,阴阳离子所带正负电荷的总数必须相等。
⑥酸碱盐电离出的阴、阳离子的个数应与其化学式中相应原子或原子团的个数相同,电离出的离子所带的电荷数应与该元素或原子团的化合价数值相等。
⑦强电解质用等号,弱电解质一律用可逆号,多元弱酸分步电离,多元弱碱一步电离。强酸的酸式盐一步电离。弱酸的酸式盐分步电离,第一步不可逆,以后步步可逆,且一步比一步的电离程度小。
本题难度:一般
4、选择题 某无色溶液能与镁反应放出氢气,此溶液中可能大量共存的离子组是AB
A.H+
B. Ba2+
C. Mg2+
D. Cl-
E.K+
F. Cl-
G. SO42-
H. AlO2-
I.K+
G. OH-
SO32-
MnO4-
Ca2+
H+
Cl-
NO3-
参考答案:A
本题解析:正确答案:A
B中AlO2―在酸性条件下不共存;C中OH―在酸性条件下不共存,D中H+ 与NO3―形成硝酸,与Mg反应得不到H2。
本题难度:简单
5、选择题 某无色溶液经定量分析得如下数据
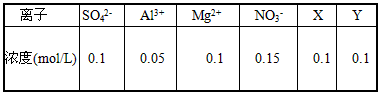
下列有关该溶液的说法中不正确的是
[? ]
A.X、Y均不可能是Fe2+
B.X、Y代表的离子所带电荷电性相反,电量相同
C.该溶液的pH<7
D.若X是H+,则Y可能是I-
参考答案:D
本题解析:
本题难度:一般