微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:Br- BrO-
BrO- BrO2-
BrO2- BrO3-,下列有关说法正确的是
BrO3-,下列有关说法正确的是
A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理
B.若改用氧气消毒,可避免生成溴酸盐
C.BrO- 3氧化性比O3强
D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生
参考答案:D
本题解析:A、臭氧消毒利用了臭氧的强氧化性,而明矾净水则利用胶体的吸附作用,两者原理不同,错误;B、氧气不能用于消毒,错误;C、BrO3-是由O3氧化生成的,故氧化性比O3弱,错误;D、溴酸盐是可能致癌物,正确。
本题难度:一般
2、选择题 在氧化还原反应的过程中,氧化反应和还愿反应同时发生,有关SO2+2H2O→SO42-+4H++2e-反应的说法错误的是?(?)
A.该反应为氧化反应
B.上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列反应中能表示氨既有还原性又有碱性的是(?)
A.NH3+HNO3====NH4NO3
B.2NH3+3Mg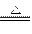 Mg3N2+3H2
Mg3N2+3H2
C.8NH3+3Cl2====N2+6NH4Cl
D.4NH3+5O2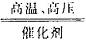 4NO+6H2O
4NO+6H2O
参考答案:C
本题解析:C中N的化合价有的变化,有的不变化,与Cl-形成盐。
本题难度:简单
4、计算题 (10分)已知:
Ⅰ.SO2通入碱溶液时:SO2+2OH-=SO32-+H2O?;SO2(过量)+OH-=HSO3-
Ⅱ.SO32-与H+反应生成SO2:① SO32-+H+= HSO3-;② HSO3-+H+ = SO2↑+H2O
(1)写出K2SO3与足量稀H2SO4反应制备SO2的离子方程式:
_________________________________________________________________。
(2)SO2与KOH溶液反应有多种可能,反应后溶液中溶质的组成可能是(填写化学式):
①K2SO3;②KHSO3;③______________ ;④?;⑤?。
(3)在数字实验中用传感器对亚硫酸钾和亚硫酸氢钾混合物样品进行测定,分别称取三份不同质量的混合物样品,配成溶液,然后用相同浓度的硫酸与之恰好反应,测得如下数据:
编号
| 1
| 2
| 3
|
混合物质量/g
| 4.36
| 5.54
| 9.81
|
硫酸溶液体积/mL
| 50.00
| 50.00
| 50.00
|
生成SO2的物质的量/mol
| 0.03
| 0.0375
| 0.03
|
求:该混合物中K2SO3与KHSO3的物质的量之比是多少?写出计算过程。
参考答案:
(1)SO32-+2H+=SO2↑+H2O?(2分)
(2)KHSO3和H2SO3;K2SO3和KHSO3;K2SO3和KOH?(各1分,共3分)
(3)由实验1或2的数据可求得,例由实验1:?
n(K2SO3)×158g/mol+120g/mol×n(KHSO3)="4.36g?" (1分)?
n(K2SO3)+n(KHSO3)="0.03mol?" (1分)
得:n(K2SO3)=0.02mol;n(KHSO3)=0.01mol。?(各1分,共2分)
则n(K2SO3)∶n(KHSO3)=2∶1?(1分)
本题解析:略
本题难度:一般
5、选择题 有人说“五颜六色”形象地说出了化学实验中的颜色变化。下列颜色变化中是由于发生氧化还原反应导致的是
①在氯水中加入NaOH溶液;
②在FeCl3溶液中加入铁粉;
③在品红溶液中通入二氧化硫气体;
④在Na2CO3溶液中滴入酚酞;
⑤在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热
[? ]
A.①②⑤?
B.①②④?
C.①②③?
D.①②③④⑤
参考答案:A
本题解析:
本题难度:简单