微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列仪器用于直接加热的是( )
A.量筒
B.容量瓶
C.集气瓶
D.坩埚
参考答案:A、量筒是用来量取一定体积的液体的仪器,不能用于加热,故A错误;
B、容量瓶是用来配制一定物质的量浓度溶液的仪器,用作定容仪器,不能加热,故B错误;
C、集气瓶是用来收集气体或存放气体的仪器,不能直接加热,故C错误;
D、坩埚可以直接加热高温灼烧固体物质,常用于直接加热,故D正确.
故选D.
本题解析:
本题难度:一般
2、填空题 (1)写出图中序号①~④仪器的名称:
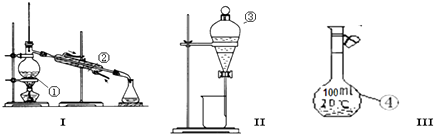
①______;②______;③______;④______.
(2)仪器①~④中,使用时必须检查是否漏水的有______.(填仪器序号)
(3)分离碘水中的碘应先选择装置______(填I、II、III)?进行操作A,再选装置______(填I,II、III),进行______操作(操作名称).进行操作A时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:______(填序号).
①常温下为液态?②I2在其中溶解程度大?③与水互溶程度小?④密度要比水大.
参考答案:(1)因①~④仪器的名称分别为:蒸馏烧瓶、冷凝管、分液漏斗、100mL容量瓶,
故答案为:蒸馏烧瓶;冷凝管;分液漏斗;100mL容量瓶;
(2)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,故答案为:③④;
(3)碘在四氯化碳中的溶解度较在水中大,并且四氯化碳和水互不相溶,可用萃取的方法分离,接着可用分液方法将两层液体分开;四氯化碳易挥发,可用蒸馏的方法分馏得到四氯化碳;碘在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和碘不反应,故答案为:II;I;蒸馏;②③.
本题解析:
本题难度:一般
3、选择题 有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.00ml刻度处。把滴定管中的溶液全部流下排出,承接在量筒,量筒内溶液的体积为
[? ]
A.大于40.00mL
B.等于40.00mL
C.小于40.00mL
D.等于10.00mL
参考答案:A
本题解析:
本题难度:简单
4、选择题 化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是?
[? ]
①用50 mL量筒量取5.2 mL稀硫酸
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量11. 7g氯化钠晶体
④用碱式滴定管取23.10 mL溴水
⑤用瓷坩埚灼烧各种钠的化合物
⑥用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液
A.①②④
B.③⑥
C.②③④⑥
D.③⑤⑥
参考答案:B
本题解析:
本题难度:简单
5、填空题 (一)(1)下图为常见仪器的部分结构(有的仪器被放大)
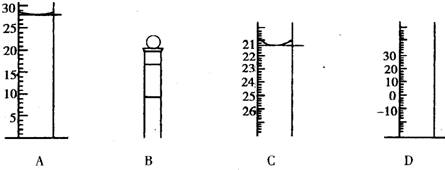
A图中液面所示溶液的体积为______mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N?mL,仰视时读数为M?mL,若M>N,则所使用的仪器是______(填字母标号).
(2)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐.
①蒸发操作中使用到的瓷质仪器的名称为______;
②该同学将所得精盐配成溶液,用于另一实验.实验中需要用80mL?l?mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为______g,用于定容的玻璃仪器的规格和名称为______.
(二)六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3、⑥NaOH.
(1)某同学想不用其他试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,他能成功吗?______?(填“能”或“不能”).
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象.该组是______;有一组在混合时,随着试剂滴加后的时间不同而出现明显不同的现象,该组是______,其中涉及氧化还原反应的化学方程式为______.
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合.试写出其中两个反应的离子方程式______、______.
(4)实际上实验室配制的FeSO4溶液不可长期保存,短期保存时可在FeSO4溶液配制时加入少量的上述______(填编号)防止水解,若能再加上______(填物质名称)效果会更好.
参考答案:(一)(1)量筒读数时要读凹液面的最低点,且精确度为0.1,则读数为28.0 mL,仰视读数,对量筒等从下到上数值增大的仪器来说是所读数值比实际值偏小,而此处偏大了,故刻度为从下到上逐渐减小,故选C,故答案为:28.0;C;
(2)①蒸发食盐溶液中的水分要用蒸发皿,蒸发皿为瓷质,故答案为:蒸发皿;
②配制80mL?l?mol/L的NaCl溶液要配制100 mL,故需食盐0.1mol,质量为5.85 g,天平的精确度为0.1g,故称量5.9 g,需要100?mL容量瓶配制溶液,
故答案为:5.9;100?mL容量瓶;?
(二) ?FeSO4H2SO4BaCl2H2O2Al(NO3)3NaOHFeSO4白色沉淀浅绿色变黄褐色白色沉淀迅速变成灰绿色,最后变成红褐色H2SO4、白色沉淀气体BaCl2白色沉淀白色沉淀H2O2浅绿色溶液变成黄褐色气体Al(NO3)3滴加氢氧化钠时硝酸铝出现白色沉淀、反之无沉淀后有沉淀NaOH白色沉淀迅速变成灰绿色,最后变成红褐色滴加氢氧化钠时硝酸铝出现白色沉淀、反之无沉淀后有沉淀(1)首先可以通过颜色可以确定有有浅绿色的为硫酸亚铁;
将硫酸亚铁滴加其他溶液,出现白色沉淀的为氯化钡,出现白色沉淀,迅速变成灰绿色,最后变成红褐色的是氢氧化钠,浅绿色逐渐变成红褐色溶液的是双氧水;
用氯化钡滴加其他的溶液,出现白色沉淀的硫酸;?用氢氧化钠滴加其他溶液,出现白色沉淀,白色沉淀又溶解的为硝酸铝,故可以区分,故答案为:能;?
(2)将氢氧化钠滴加到硝酸铝中,出现白色沉淀,白色沉淀不溶解,将硝酸铝滴加到氢氧化钠中出现白色沉淀立刻回消失得到澄清溶液,故随着试剂滴加的顺序不同而出现明显不同的现象是⑤和⑥;
将硫酸亚铁与氢氧化钠,反应产生白色沉淀,迅速变成灰绿色,最后变成红褐色,故随着试剂滴加后的时间不同而出现明显不同的现象为①和⑥,氧化还原反应的化学方程式为氢氧化亚铁与氧气的反应生成氢氧化铁4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:⑤和⑥;①和⑥;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)Fe2+还原性即将亚铁离子氧化为铁离子的过程,可以为硫酸亚铁与双氧水的反应液可以为与硝酸的反应,离子方程式如下:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O、
2Fe2++2H++H2O2═2Fe3++2H2O,故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;2Fe2++2H++H2O2═2Fe3++2H2O;
(4)配制硫酸亚铁时用硫酸溶解,可以防止硫酸亚铁的水解②亚铁离子在溶液中易被氧化成铁离子,加入铁钉可以与铁离子反应生成亚铁离子.
故答案为:②;几枚铁钉.
本题解析:
本题难度:一般