微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室配制480mL?0.5mol?L-1的NaOH溶液时,下列操作会使结果偏低的是( )
A.溶解后没有冷却就转移到容量瓶中
B.洗涤容量瓶后未干燥,瓶中仍有少量的水即进行
C.定容时俯视刻度线
D.用托盘天平称量9.6g的氢氧化钠固体
参考答案:D
本题解析:
本题难度:简单
2、填空题 欲用胆矾(CuSO4?5H2O)配制480mL?0.1mol?L-1的CuSO4溶液.根据题意填空:
(1)如图所示仪器,配制上述溶液肯定不需用到的是______(填字母),配制上述溶液还需要的玻璃仪器有______(填仪器名称).
(2)配制该溶液应选用______?mL容量瓶,使用容量瓶之前必须进行______.
(3)配制该溶液应用托盘天平称取______?g胆矾.
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是______(填编号).
? ①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
? ②向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面
? ③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
? ④转移溶液前容量瓶内有少量蒸馏水
? ⑤定容时,仰视容量瓶的刻度线
? ⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.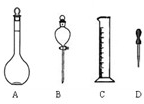
参考答案:(1)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以不需要的仪器有分液漏斗,故答案为:B、烧杯、玻璃棒;
(2)因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml容量瓶,容量瓶在使用前要进行检漏,故答案为:500ml容量瓶;检漏;
(3)配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml容量瓶,CuSO4的物质的量n=cV=0.5L×0.1mol?L-1=0.05mol,CuSO4?5H2O的物质的量等于CuSO4的物质的量,所以CuSO4?5H2O的质量0.05mol×250g/mol=12.5g,故答案为:12.5;
(4)①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了,物体的质量偏小,浓度偏小,故①正确;
②向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面,因液体中含有溶质,溶质的质量减少,浓度偏小,故②正确;
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,因烧杯和玻璃棒上沾有溶质,溶质的质量减少,浓度偏小,故③正确;
④转移溶液前容量瓶内有少量蒸馏水,对溶液的体积无影响,浓度不变,故④错误;
⑤定容时,仰视容量瓶的刻度线,溶液的液面比刻度线高,溶液的体积偏大,浓度偏小,故⑤正确;
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,过会儿滞留在刻度线以上的液体会下落,溶液的体积偏大,浓度偏小,故⑥正确;
故选:①②③⑤⑥.
本题解析:
本题难度:一般
3、选择题 配制250mL0.2mol/L稀H2SO4溶液时,下列操作可能导致浓度偏低的是( )
A.浓硫酸稀释后,没有冷却直接转移到容量瓶中
B.定容时俯视刻度线
C.转移过程中没有洗涤小烧杯
D.容量瓶洗净后,没有干燥
参考答案:A、浓硫酸稀释后,没有冷却直接转移到容量瓶中,会导致配制的溶液体积偏小,根据c=nV可知,配制的溶液的物质的量浓度偏高,故A错误;
B、定容时俯视刻度线,会导致加入的蒸馏水体积偏小,根据c=nV可知,配制的溶液的物质的量浓度偏高,故B错误;
C、转移过程中没有洗涤小烧杯,导致配制的溶液中溶质的物质的量偏小,根据c=nV可知,配制的溶液的物质的量浓度偏低,故C正确;
D、由于定容时还需要加入蒸馏水,所以容量瓶洗净后没有干燥,对溶质的物质的量、溶液的体积没有影响,不影响配制结果,故D错误;
故选:C.
本题解析:
本题难度:简单
4、简答题 工业上利用某合金废料(含铁、铜、碳)为原料制备CuSO4和(NH4)2SO4?FeSO4?6H2O(莫尔盐)的工艺流程如下:

回答下列问题:
(1)实验室用容量瓶配制一定物质的量浓度的稀硫酸,定容时若俯视刻度线,则会导致配制的溶液浓度______(填“偏大”、“偏小”或“无影响”).
(2)步骤②和步骤③中会产生同一种气体,生成该气体的离子方程式为:______.
(3)用Cu和混酸(稀硫酸、稀硝酸)制备CuSO4溶液时,为得到纯净的CuSO4溶液,混酸中硫酸和硝酸的浓度之比最好为______.
(4)浓度均为0.1mol?L-1的莫尔盐溶液和(NH4)2SO4溶液中,c(NH4+)前者大于后者,原因是______.
(5)莫尔盐比绿矾(FeSO4?7H2O)更稳定,常用于定量分析.利用莫尔盐溶液可将酸性KMnO4还原为Mn2+,反应的离子方程式为:______.
(6)某化学兴趣小组设计用如图所示装置制备(NH4)2SO4溶液.
①装置A圆底烧瓶中的固体试剂为______(填试剂名称).
②将装置B中两种液体分离开,所需的最主要的玻璃仪器为______(填仪器名称).
③装置C的作用为______.
参考答案:(1)定容时若俯视刻度线,导致所配溶液的体积偏小,所配溶液的浓度偏大,
故答案为:偏大;
(2)由工艺流程可知,溶液A中含有硫酸,滤渣B中含有铁,Fe与硫酸反应生成硫酸亚铁与氢气,反应离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(3)根据反应3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O可知,混酸中硫酸和硝酸的浓度之比最好为3:2,
故答案为:3:2;
(4)(NH4)2SO4溶液中,NH4+的水解,莫尔盐溶液中Fe2+的水解显酸性,抑制了NH4+的水解莫尔盐溶液中c(NH4+)较低,
故答案为:莫尔盐溶液中Fe2+的水解显酸性,抑制了NH4+的水解;
(5)酸性条件下KMnO4氧化Fe2+为Fe3+,自身被还原为Mn2+,同时生成水,反应离子方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
(6)①由装置可知,A装置中浓氨水与固体混合产生氨气,A中盛放的为生石灰或氢氧化钠、碱石灰等,
故答案为:生石灰或氢氧化钠、碱石灰等;
②分离互不相溶的液体的操作是分液,利用的仪器是分液漏斗,
故答案为:分液漏斗;
③尾气中含有氨气,直接排放会污染空气,故装置C的作用为吸收尾气,防止氨气污染空气,
故答案为:吸收尾气,防止氨气污染空气.
本题解析:
本题难度:一般
5、选择题 下列图示实验合理的是
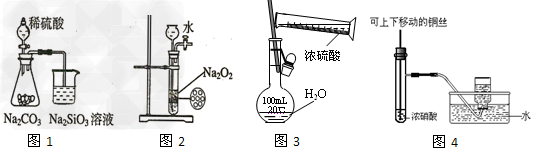
[? ]
A.图1为证明非金属性强弱: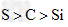 ?
?
B.图2为制备少量氧气?
C.图3为配制一定浓度硫酸溶液?
D.图4制备并收集少量NO2气体
参考答案:A
本题解析:
本题难度:一般