微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
A.0.50mol/L
B.0.60mol/L
C.0.45mol/L
D.0.55mol/L
参考答案:B
本题解析:根据反应的化学方程式为:N2+3H2 2NH3可得 :V(H2):V(NH3 )="3:2" 。V(NH3 )=(2∕3)V(H2)= (2∕3)×0.45mol/(L·s)="0.30" mol/(L·s)。所以2s末NH3的浓度为:C(NH3)="Δt" ·V(NH3 )="2s×=0.30" mol/(L·s)="0.60" mol/L。选项为:B。
2NH3可得 :V(H2):V(NH3 )="3:2" 。V(NH3 )=(2∕3)V(H2)= (2∕3)×0.45mol/(L·s)="0.30" mol/(L·s)。所以2s末NH3的浓度为:C(NH3)="Δt" ·V(NH3 )="2s×=0.30" mol/(L·s)="0.60" mol/L。选项为:B。
本题难度:一般
2、实验题 (10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。
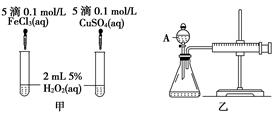
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) 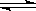 ?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
参考答案:(1)反应产生气泡快慢;控制阴离子相同,排除阴离子的干扰
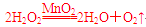
(2)分液漏斗 收集40mL气体所需要的时间 关闭A上的玻璃旋塞,将针筒的活塞拉出(或推进)一段后松开,活塞能回到原来的位置说明气密性良好(其他答案合理也给分)
(3)v(X)=v(W)=0.05 mol·L-1·min-1; 0.25 mol/L;4
(4)A
本题解析:(1)催化剂的不同会引起反应速率的不同,所以根据反应中产生气泡的快慢来定性分析催化剂的催化效果。为了是实验具有可比性,应该使溶液中的阴离子也相同,这样才能排出阴离子不同可能组成的干扰。
(2)从外观分析A是分液漏斗,收集相同的体积,因此需要测量所用时间的长短。由于装置的右侧是带有活塞的针筒,所以检验其气密性时不能利用传统的方法检验,正确的方法是关闭A上的玻璃旋塞,将针筒的活塞拉出(或推进)一段后松开,活塞能回到原来的位置说明气密性良好,否则漏气。
(3)以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),因此生成Z的物质的量是0.1 mol/(L·min)×2L×2min=0.4mol,同时生成W是0.2mol,因为物质的变化量之比是相应的化学计量数之比,所以n等于4.。因为物质的量的变化量和相应的化学计量数是成正比的,所以速率之比应该是相应的化学计量数之比,故用X的物质的量浓度变化表示的平均反应速率也是0.05 mol/(L·min)。生成0.2molW,就必然消耗0.1molY,则剩余Y是0.5mol,所以2 min末时Y的物质的量浓度为0.25mol/L。
(4)因为反应前后气体的体积是不变的,所以在反应过程中压强始终是不变的,A不正确。密度是混合气的质量和容器容积的比值,容积不变,但混合气的质量是变化的,所以当混合气的密度不再随时间而变化时,可以说明达到平衡状态。A的质量不再改变,说明正逆反应速率相等,因此选项C正确。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,混合气的物质的量不变,但质量是变化的,因此当平衡混合气体的平均相对分子质量不再改变时可以说明已经达到平衡状态。
本题难度:一般
3、选择题 在mA+nB
pC的反应中m、n、p为各物质的化学计量数,现测得C每分钟增加aMol/L,B每分钟减小1.5a?mol/L,A每分钟减少0.5a?mol/L,则m:n:p为( )
A.2:3:2
B.2:2:3
C.1:3:2
D.3:1:2
参考答案:浓度的变化量与时间的比值为反应速率,所以A、B、C的反应速率分别是0.5a?mol/Lmin、.1.5a?mol/L.min、
amol/L.min,在同一反应中,各物质的反应速率之比等于其计量数之比,所以A、B、C的计量数之比=0.5a?mol/Lmin
:1.5a?mol/L.min:amol/L.min.=1:3:2,故选C
本题解析:
本题难度:一般
4、选择题 用铁片与稀硫酸制取氢气时,下列措施能使氢气生成速率减缓的是( )
A.使用更稀的硫酸溶液
B.加热
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
参考答案:A.使用更稀的硫酸溶液,反应物浓度减小,反应速率降低,故A选;
B.加热,温度升高,反应速率增大,故B不选;
C.滴加少量CuSO4溶液,铁置换出铜,形成原电池反应,反应速率增大,故C不选;
D.改用铁粉,接触面积大,反应速率增大,故D不选.
故选A.
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是
A.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷
B.对于可逆反应N2(g)+3H2(g)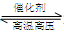 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3
D.BaS04在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同
参考答案:A
本题解析:A:前者有三种氢、后者有两种氢,正确
B:增大氮气浓度只能增加单位体积内活化分子个数,但活化分子百分数并没有改变,不正确
C:所得固体除Al2O3外,还有NaCl,不正确
D:两溶液中硫酸根离子的浓度不同,对沉淀溶解平衡的抑制程度不相等,故BaS04的溶解度不相同,排除
答案为A
本题难度:一般