| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《电解池原理》考点强化练习(2017年押题版)(十)
参考答案:B 本题解析:A、通电氯化铜发生氧化还原反应生成氯气和铜,电离是氯化铜离解为阴阳离子,故A错误;B、依据装置图可知,铜离子移向的电极为阴极,阴极和电源负极相连,a为负极,故B正确;C、与b连接的电极是阳极,氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,故C错误;D、通电一段时间后,氯离子在阳极失电子发生氧化反应,在阳极附近观察到黄绿色气体,故D错误;故选B。 本题难度:一般 2、选择题 如图所示,下列叙述正确的是 参考答案:A 本题解析: 本题难度:一般 3、选择题 下列关于铜电极的叙述正确的是 参考答案:AC 本题解析: 本题难度:一般 4、填空题 氯碱工业中电解饱和食盐水的原理示意图如下图所示: 参考答案:(1)NaOH 本题解析:(1)电解时,阴极H+放电,阳极Cl-放电,因此溶液中溶质是NaOH。 本题难度:一般 5、填空题 (8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因: (2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程: 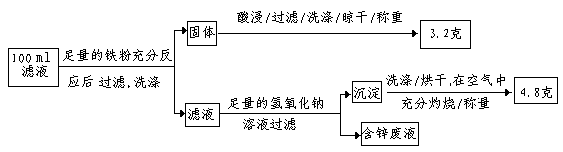 则100ml滤液中Fe2+的浓度为 mol·L-1 参考答案:步骤一: Cu2++2e = Cu 3Ag + 4H+ + NO3—= 3Ag+ + NO ↑+ 2H2O 浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4—离子,使反应2平衡向右移动,则金溶于王水中。 0.1 本题解析:步骤一:电解精制铜。电解精炼铜时,以粗铜作阳极,以精铜作阴极,阳极发生氧化反应:Cu-2e-=Cu2+,阴极发生还原反应: Cu2+ +2e-=" Cu." (1)步骤二.粗铜中含有少量的锌、铁、银、金等金属.在铜在阳极被氧化为铜离子时,比铜活泼的锌、铁也被氧化成离子进入溶液。Zn-2e-=Zn2+;Fe-2e-=Fe2+。比铜弱的银、金则以固体的形式存在阳极的下面沉淀中。俗称阳极泥。稀硝酸和银反应的离子方程式:3Ag + 4H+ + NO3- = 3Ag+ + NO ↑+ 2H2O。金能够被王水溶解原因是浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4—离子,使反应2平衡向右移动,则金溶于王水中。(2)由(1)的分析知:在100ml的滤液中含有Cu2+、Fe2+ Zn2+。当向其中加入足量的Fe粉时发生反应:Fe+Cu2+=" Cu" +Fe2+。得到的固体中含有过量的Fe和反应产生的Cu。经过酸浸时Fe与酸反应转化为Fe2+进入溶液中,剩余不反应的Cu单质。3.2g固体就是Cu的质量。n(Cu)="3.2g÷64g/mol=0.05mol." 在100ml的溶液中加入足量的Fe粉过滤得到的含有Fe2+和Zn2+。当向其中加入足量的氢氧化钠溶液时发生反应:Zn2++4OH-=ZnO22-+2H2O; Fe2+2OH -=Fe(OH)2↓.沉淀为Fe(OH)2。沉淀经洗涤、烘干在空气中充分灼烧发生反应:4 Fe(OH)2+O2+2H2O="4" Fe(OH)3, 2Fe(OH)3 本题难度:困难 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《物质的组成.. | |