微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硼有两种天然同位素105B和115B,已知硼元素的原子量为10.8。下列对硼元素中105B的质量分数的判断正确的是
A.等于20%
B.略小于20%
C.略大于20%
D.等于80%
参考答案:B
本题解析:设总物质的量为1mol,则质量为10.8g
设105 B的物质的量为xmol,则115B为(1-x)mol根据平均分子量的计算公式得:
10x+11×(1-x)=10.8
x=0.2mol
所以质量分数为: 正确答案为B。
正确答案为B。
本题难度:简单
2、选择题 短周期主族元素X、Y、Z最外层电子数之和为11,它们在周期表中的相对位置如下图所示。下列关于X、Y、Z元素的说法正确的是
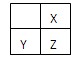
A.X、Z的高价态氧化物性质相似
B.工业上常用电解法生产Y的单质
C.原子半径的大小顺序为rX<rY<rZ
D.元素X的最高价氧化物对应的水化物的酸性比Z的弱
参考答案:B
本题解析:根据元素的结构可知,短周期主族元素X、Y、Z分别是C、Al、Si。A不正确,CO2和二氧化硅的结构性质差别很大。铝是活泼的金属,通过电解法冶炼,B正确。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,C不正确。非金属性越强,最高价氧化物的水化物的酸性越强,碳的非金属性强于硅的,所以D不正确。答案选B。
本题难度:一般
3、选择题 下列判断中一定正确的是
A.若R2-和M+的电子层结构相同,则原子序数:R>M
B.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
C.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N
D.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强
参考答案:D
本题解析:A、若R2-和M+的电子层结构相同,则离子的核外电子数相同。由于前者是阴离子,质子数=核外电子数-2,后者是阳离子,质子数=核外电子数+1,所以原子序数:R<M,A不正确;B、一般情况下,氢化物的相对分子质量越大,沸点越高。但由于HF、H2O以及NH3分子中存在氢键,因此沸点高于同主族元素氢化物的沸点,B不正确;C、同主族自上而下,非金属性逐渐减弱,因此若M、N是同主族元素,且原子序数:M>N,则非金属性:M<N,C不正确;D、同主族自上而下金属性逐渐增强,相对原子质量逐渐减小,所以若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强,D正确,答案选D。
本题难度:一般
4、选择题 设X、Y、Z代表三种元素。已知:
(1) 和
和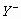 两种离子具有相同的电子层结构;
两种离子具有相同的电子层结构;
(2)Z元素原子核内质子数比Y元素原子核内质子数少9个;
(3)Y和Z两种元素可以形成4核42电子的 价阴离子。
价阴离子。
据此,请填空:
(1)Y元素是___________,Z元素是_____________。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是______。
参考答案:(1)氯、氧(2)
本题解析:考查原子结构与元素推断,依题意,假设Y元素的原子序数为y,则Z元素的原子序数为 。若以
。若以 表示由这两种元素所形成的4核42电子的
表示由这两种元素所形成的4核42电子的 价阴离子,则下列关系式成立:
价阴离子,则下列关系式成立:
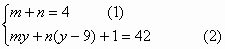
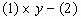 得
得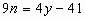
所以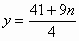
因为n为整数,将其可能的取值1、2和3分别代入上式,经检验确定: ,
,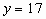 。所以,Y元素的原子序数为17,它是氯元素,而元素Z的原子序数
。所以,Y元素的原子序数为17,它是氯元素,而元素Z的原子序数 ,它是氧元素,进而可知X元素为钾元素,这三种元素所形成的含68个电子的盐类化合物的化学式为
,它是氧元素,进而可知X元素为钾元素,这三种元素所形成的含68个电子的盐类化合物的化学式为 (所含电子数为:
(所含电子数为: )
)
本题难度:简单
5、选择题 下列排列顺序不正确的是
A.热稳定性:HF>HCl>HBr
B.原子半径:Na>S>O
C.酸性:H3PO4>H2SO4>HClO4
D.元素金属性:Na>Mg>Al
参考答案:C
本题解析:略
本题难度:简单