微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.甲烷、汽油、生物柴油、酒精都是碳氢化合物,都可作燃料
B.可食用植物油含有的高级脂肪酸甘油酯是人体的营养物质
C.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高
D.用CuSO4溶液使蛋清溶液发生盐析,进而提纯分离蛋白质
参考答案:A.酒精含有碳氢氧元素,不属于碳氢化合物,故A错误;
B.高级脂肪酸甘油酯是人体的营养物质,故B正确;
C.铁在海水中易腐蚀的原因是因为海水中含有大量的电解质,形成了无数微小的原电池造成的,不是因为海水中含氧量高造成的,故C错误;
D.硫酸铜是重金属盐,能使蛋白质发生变性,变性是不可逆过程,故D错误.
故选B.
本题解析:
本题难度:简单
2、选择题 钢铁在潮湿空气中发生电化学腐蚀时,正极发生的主要反应是? (? )
A.Fe-2e=Fe2+
B.2H2O+O2+4e=4OH-
C.4OH- -4e=2H2O+O2
D.2H++2e=H2
参考答案:B
本题解析:在钢铁中含有杂质碳等,铁是活泼的金属,作负极。钢铁发生的腐蚀大部分是吸氧腐蚀,所以在正极是溶解在水中的氧气得到电子,发生还原反应。答案是B。
本题难度:简单
3、选择题 下列说法正确的是(?)
A.镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀
B.埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀
C.钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-e-= Fe3+
D.在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀
参考答案:A
本题解析:在潮湿的环境中钢铁更易生锈,B不正确;原电池中负极是失去电子,正极得到电子,C不正确;油漆能隔绝空气,能达到防止钢铁锈蚀,D不正确,所以正确的答案选A。
点评:原电池的正负极的判断(从原电池反应实质角度确定):
(1)由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
(2)由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
本题难度:一般
4、选择题 下列有关金属的说法正确的是(? )
A.不锈钢不易生锈是因为表面有致密保护层
B.纯银的器皿在空气中久置表面变暗是因为发生电化学腐蚀
C.当镀锌铁制品的镀层破损时,镀层还能对铁制品起保护作用
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
参考答案:C
本题解析:不锈钢不易生锈是因为改变了金属的内部结构,所以不容易生锈,A不正确;纯银的表面久置变暗淡,是因为发生化学腐蚀,B错误;镀锌铁制品,由于镀层金属锌比金属铁要活泼,所以即使镀层破坏,锌和铁构成原电池,锌做负极,镀层也能起到保护铁制品,所以C正确;地下输油钢管若与外加直流电源正极相连,构成电解池容易腐蚀钢管,D错误;故选C。
本题难度:一般
5、选择题 下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是(?)
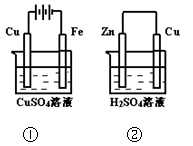
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上生成物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑
D.溶液的pH:①不变;②增大
参考答案:D
本题解析:①为电解池,Cu为阳极不 断溶解,Fe为阴极,有Cu析出,整个过程为电镀,Cu2+浓度不变。②为原电池,活泼金属做负极,即锌为负极,溶解,铜为正极,析出氢气,氢离子浓度不断减小。
本题难度:一般