微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向某晶体中加入含Fe2+的溶液后,无明显变化,当滴加几滴新制氯水时,混合液变成血红色,则下列结论中错误的是
A.该晶体中一定含有SCN—
B.氧化性:Fe3+> Cl2
C.Fe2+与SCN—不能形成红色物质
D.Fe2+被氯水氧化成Fe3+
2、实验题 绿矾(FeSO4·7H2O)、硫酸亚铁铵(FeSO4·(NH4 )2SO4·6H2O)是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
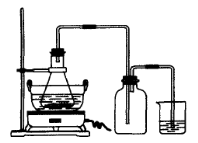 ?
?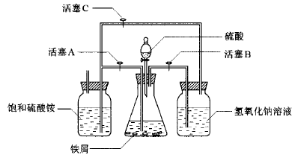
图Ⅰ?图Ⅱ
请回答下列问题:
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是__________,集气瓶的作用是__________;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___? ___,其作用是_______________。
(2)图Ⅱ用于制备硫酸亚铁铵。在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞____________,关闭活塞_________,从分液漏斗滴入6 mol·L-1 H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞________,打开活塞________。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号
| 反应物用量
| 产品质量
|
1
| n(H2SO4):n(Fe)>1:1
| 介于Ⅰ级~Ⅱ级之间
|
2
| n(H2SO4):n(Fe)<1:1
| 优于Ⅰ级
|
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制___________过量为最佳。
3、选择题 在一定条件下,下列物质的转变不能一步完成的是( )
A.Na2CO3→CaCO3
B.Fe2O3→Fe
C.CaO→Ca(OH)2
D.CuO→Cu(OH)2
4、填空题 (14分)针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是?;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:?;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式:?。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式?。
(3)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。

[实验2]将适量K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是?;
②实验2可得出的结论是?;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是?。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是?。
5、计算题 (9分)向Fe3O4和 Fe的固体混合物6.88g中加入50ml 2 mol·L—1H2SO4,恰好使固体完全溶解,并放出一定量气体。在所得溶液中加入KSCN溶液,溶液不变红色。
(1)?写出Fe3O4和稀H2SO4反应的化学方程式______________________________。
(2)?混合物中Fe3O4和 Fe的物质的量(写出计算过程)。
(3)?求反应中产生的气体在标准状况下的体积。(写出计算过程)。
若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量。(写出计算过程)。