微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向某晶体中加入含Fe2+的溶液后,无明显变化,当滴加几滴新制氯水时,混合液变成血红色,则下列结论中错误的是
A.该晶体中一定含有SCN—
B.氧化性:Fe3+> Cl2
C.Fe2+与SCN—不能形成红色物质
D.Fe2+被氯水氧化成Fe3+
参考答案:B
本题解析:考查铁离子的性质及检验
由反应Cl2+2Fe2+=2Fe 3++2Cl-可知,氯气将亚铁离子氧化为铁离子,前者的氧化性强,原晶体中含有SCN—,出现血红色现象,故答案为B
本题难度:一般
2、实验题 绿矾(FeSO4·7H2O)、硫酸亚铁铵(FeSO4·(NH4 )2SO4·6H2O)是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
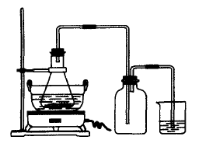 ?
?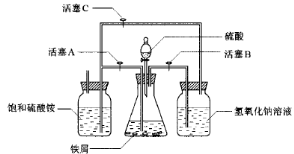
图Ⅰ?图Ⅱ
请回答下列问题:
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是__________,集气瓶的作用是__________;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___? ___,其作用是_______________。
(2)图Ⅱ用于制备硫酸亚铁铵。在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞____________,关闭活塞_________,从分液漏斗滴入6 mol·L-1 H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞________,打开活塞________。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号
| 反应物用量
| 产品质量
|
1
| n(H2SO4):n(Fe)>1:1
| 介于Ⅰ级~Ⅱ级之间
|
2
| n(H2SO4):n(Fe)<1:1
| 优于Ⅰ级
|
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制___________过量为最佳。
参考答案:(1)铁屑、稀硫酸;安全瓶作用,防止烧杯中的洗液倒吸至锥形瓶中污染产物;CuSO4溶液;吸收H2S、PH3等尾气。
(2)BC,A;BC(或B),A
(3)铁
本题解析:(1)根据提示方程式,可以推知尾气中当含有H2S、PH3等,烧杯里盛放硫酸铜溶液。
(2)本题利用产生的气体所造成的压强的变化,将锥形瓶中产生的硫酸亚铁溶液挤压进入硫酸铵溶液以制备硫酸亚铁铵。考虑到亚铁离子的强还原性,故需要保证析出时处于一个还原性的保护气氛下,铁和硫酸反应放出的氢气恰可实现该目的。故开始时需要通过活塞的打开、关闭的选择让氢气进入硫酸铵溶液的试剂瓶,然后让氢气在锥形瓶中聚集增大压强以将硫酸亚铁溶液挤压进入硫酸铵溶液。
本题难度:一般
3、选择题 在一定条件下,下列物质的转变不能一步完成的是( )
A.Na2CO3→CaCO3
B.Fe2O3→Fe
C.CaO→Ca(OH)2
D.CuO→Cu(OH)2
参考答案:D
本题解析:
本题难度:简单
4、填空题 (14分)针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是?;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:?;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式:?。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式?。
(3)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。

[实验2]将适量K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是?;
②实验2可得出的结论是?;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是?。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是?。
参考答案:(14分)(1)先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色(2分)
硫氰根被氧化(2分)? 2H2O2  2H2O+O2↑(2分必须注明催化剂)
2H2O+O2↑(2分必须注明催化剂)
(2)2Fe3++3Cl2+8H2O==2FeO42- +6Cl-+16H+?(2分)
(3)①研究FeO42-在不同pH溶液中的稳定性(或反应的速率)(2分)
②温度越高,FeO42-越不稳定(或与水反应的速率越快)(2分)
③pH=11.50的溶液中OH—离子浓度大,使平衡向左移动?(2分)
本题解析:(1)亚铁离子具有还原性,据此可以鉴别,微粒排除铁离子的干扰,有关首先加热KSCN溶液,即先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;由于硫氰根也极易被氧化,所以在实验中往往又看到血红色迅速褪去;双氧水不稳定,易分解生成氧气,反应的方程式是2H2O2  2H2O+O2↑。
2H2O+O2↑。
(2)根据反应物和生成物可以写出该反应的方程式为2Fe3++3Cl2+8H2O==2FeO42- +6Cl-+16H+。
(3)①实验①中不同的是溶液的pH值,所以实验目的是探究FeO42-在不同pH溶液中的稳定性(或反应的速率)。
②根据图②可知,温度越高,FeO42-的浓度越低,说明升高温度,FeO42-越不稳定(或与水反应的速率越快)。
③pH=11.50的溶液中OH—离子浓度大,根据勒夏特列原理可知,增大OH-的浓度平衡向逆反应方向移动,所以pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高。
本题难度:一般
5、计算题 (9分)向Fe3O4和 Fe的固体混合物6.88g中加入50ml 2 mol·L—1H2SO4,恰好使固体完全溶解,并放出一定量气体。在所得溶液中加入KSCN溶液,溶液不变红色。
(1)?写出Fe3O4和稀H2SO4反应的化学方程式______________________________。
(2)?混合物中Fe3O4和 Fe的物质的量(写出计算过程)。
(3)?求反应中产生的气体在标准状况下的体积。(写出计算过程)。
若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量。(写出计算过程)。
参考答案:(1)Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O(1分)
(2)n(Fe3O4)="0.02" mol;? n(Fe)="0.04" mol 。(每空2分)
(3)448ml(2分)?(4)5.6g(2分)
本题解析:(2)设Fe、Fe3O4的物质的量分别为n1,n2,
56n1+232n2="6.88g" ①
据题意,得:反应过程中,发生了以下3个反应,
Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O? Fe+Fe2(SO4)3=3FeSO4?Fe+H2SO4=FeSO4+H2↑
1? 4? 1? 1? 1? 1? 1?
n2? 4n2? n2? n2 ?n2?(n1- n2)(n1- n2)
则:4n2+(n1- n2)=0.05L×2 mol·L—1="0.1mol" ②
联立①②,得n1="0.04mol" ,n2=0.02mol
(3)V(H2)=22.4L.mol-1×(n1- n2)= 448ml
(4) Fe3O4+4CO=高温=3Fe+ 4CO2
1? 3
0.02mol? 0.06mol
最终能得到铁的质量:(0.06mol+0.04mol)×56g.mol-1=5.6g
本题难度:一般