| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《氧化性和还原性强弱的比较》在线测试(2017年最新版)(八)
参考答案:B 本题解析:根据同一反应中氧化剂的氧化性大于氧化产物的氧化性判断各物质的氧化性强弱。(1)Cl2+2KI=2KCl+I2,氧化剂是Cl2,氧化产物是I2,Cl2的氧化性大于I2的氧化性;(2)2FeCl2+Cl2="2" FeCl3,氧化剂是Cl2,氧化产物是FeCl3,所以Cl2的氧化性大于FeCl3的氧化性;(3)2FeCl3+2HI=2FeCl2+2HCl+I2,氧化剂是FeCl3,氧化产物是I2,FeCl3的氧化性大于I2的氧化性;(4)H2S+I2=S↓+2HI,氧化剂是I2,氧化产物是S,I2的氧化性大于S的氧化性;各物质的氧化性大小顺序为:Cl2>Fe3+>I2>S,选B。 本题难度:一般 3、实验题 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(4)应用与拓展: ①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为?。 ②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 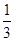 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为?。 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为?。参考答案:(2)①Br2 ②Fe3+ 本题解析:(2)①若氧化性Fe3+>Br2,则Br2不能氧化Fe2+,故溶液呈黄色是加入的Br2的颜色。②若氧化性Br2>Fe3+,则Br2能将Fe2+氧化成Fe3+,故溶液呈黄色是因为生成的Fe3+显黄色。(4)②氧化性Br2>Fe3+,则还原性Fe2+>Br-,Cl2通入FeBr2溶液中先与Fe2+反应,若Cl2还有剩余再与Br-发生反应。现有 本题难度:一般 4、选择题 已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断不正确的是 ( ) |
参考答案:A
本题解析:反应①为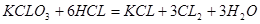 ;反应②为
;反应②为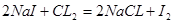 ;所以
;所以
A错,实验③为实验②中生成的碘单质使淀粉KI试纸变蓝,KI并没有被氧化;B正确,实验②中氧化剂与还原剂的物质的量之比为1:2;C正确实验①证明Cl—具有还原性;D正确氧化性:ClO3—>Cl2>I2;
本题难度:一般
5、选择题 已知:①2BrO3-+Cl2===Br2+2ClO3-;②5Cl2+I2+6H2O===2HIO3+10HCl; ③ClO3-+5Cl-+6H+===
3Cl2↑+3H2O。下列物质按氧化性由强到弱的顺序排列正确的是
[? ]
A.Cl2>BrO3->ClO3->IO3-
B.BrO3->ClO3->Cl2>IO3-
C.ClO3->BrO3->IO3->Cl2
D.BrO3->Cl2>ClO3->IO3-
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《铁的氧化物.. | |