|
高中化学知识点大全《物质的组成》试题特训(2017年最新版)(四)
2017-08-26 01:00:44
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 兰州近代物理研究所制备出一种比黄金贵百倍的18O2气体,下列关于18O2的叙述正确的是
A.1个分子中含18个中子
B.标准状况下,密度比16O2大
C.在化学反应中易失电子
D.一定条件下与S16O2反应,得到的三氧化硫的相对分子质量必为82
参考答案:B
本题解析:略
本题难度:简单
2、选择题 卤素单质可以参与很多化学反应, 如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;反应①: 2NH3+3F2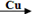 NF3+ 3NH4F NF3+ 3NH4F
利用“化学蒸气转移法”制备TaS2晶体; 反应②:TaI4(g)+S2(g)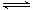 TaS2(s)+2I2(g)+Q kJ,Q>0 TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有_________种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有____________种自旋方向。
(2)反应①中:物质所属的晶体类型有________________________________;
并写出所有原子符合8电子稳定结构的化合物的电子式_______________________。
(3)反应②中:平衡常数表达式K=_____________________,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 ______________。
A.平衡常数K增大
B.S2的浓度减小
C.I2的质量减小
D.V(TaI4)逆 增大
| (4)反应②在一定温度下进行,若反应容器的容积为2 L,3 min后达到平衡,测得蒸气的质量减少了2.45 g,则I2的平均反应速率为 _________________。
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____________(填增大或减小),其原因是________________________ 。
参考答案:(1)9?、 2
(2)分子晶体、金属晶体、离子晶体?; ? ?
(3) ; A? B ; A? B
(4)0.00333或1/300mol/(L·min)
(5)该同学认为加压对TaI4平衡转化率会减小,原因是在S2可以转化为S4或S6或S8
2TaI4(g)+S4(g)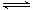 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行
本题解析:
(1)在反应①中非金属性最强的元素是F,其核外电子排布是1s22s22p5.可见有9种不同运动状态的电子。在该反应中的某元素的单质可作粮食保护气,则该元素为N,其核外电子排布是1s22s22p3.在它的最外电子层有顺时针方向和逆时针方向两种不同的自旋方向。
(2)反应①中, NH3、3F2、NF3是由分子构成的分子晶体,Cu是由金属键构成的金属晶体,而NH4 F则是含有极性共价键和离子键的离子晶体。其中所有原子符合8电子稳定结构的化合物NF3的电子式是
(3)平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与个反应物浓度幂指数乘积的比。反应②中平衡常数表达式 。由于反应②的正反应是气体体积增大的放热反应。所以反应达到平衡后,保持其他条件不变,降低温度,根据平衡移动原理:降低温度,化学平衡向放热反应方:向移动。对该反应来说化学平衡向正反应方向移动,所以化学平衡常数增大。正确。B.由于降低温度,平衡正向移动,所以反应物的浓度减小。正确。C. 平衡正向移动,产生更多的I2,所以c(I2)增大,I2的质量增大。错误。D. 降低温度,无论是放热反应,还是吸热反应,反应速率都减小。错误。因此正确选项为AB。 。由于反应②的正反应是气体体积增大的放热反应。所以反应达到平衡后,保持其他条件不变,降低温度,根据平衡移动原理:降低温度,化学平衡向放热反应方:向移动。对该反应来说化学平衡向正反应方向移动,所以化学平衡常数增大。正确。B.由于降低温度,平衡正向移动,所以反应物的浓度减小。正确。C. 平衡正向移动,产生更多的I2,所以c(I2)增大,I2的质量增大。错误。D. 降低温度,无论是放热反应,还是吸热反应,反应速率都减小。错误。因此正确选项为AB。
(4)n(TaS2)=" 2.45" g÷245 g/mol=0.01mol.则生成I2的物质的量为0.02mol。所以I2的平均反应速率为V=Δc÷Δt=(0.02mol÷2L)÷3min=0.00333或1/300mol/(L·min).
(5)他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会减小,其原因是在S2可以转化为S4或S6或S8。2TaI4(g)+S4(g)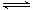 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行。 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行。
本题难度:一般
3、选择题 今年3月11日发生在日本近海的9.0级地震使日本福岛第一核电站2号机组发生爆炸,放射性物质131? 53I扩散到周围环境中引发了放射性污染,下列有关131? 53I叙述正确的是
A.131 53I是碘的一种同素异形体
B.131 53I是一种新发现的元素
C.131 53I位于元素周期表中第4周期ⅦA族
D.131 53I核内的中子数与核外电子数之差为25
参考答案:D
本题解析:考查原子的组成。在表示原子的组成时,元素符号的左下角表示质子数,左上角表示质量数。因此131? 53I表示质子数为53,质量数是131的一种核素,含有的中子数是131-53
本题难度:简单
4、选择题 现在含有元素硒(Se) 的保健品已经开始进入市场, 已知它与氧元素同族, 与 K 同周期,
关于硒的说法中不正确的是
A.原子序数为 34
B.最高价氧化物的水化物的分子式为: H2SeO4
C.Se 的非金属性比 Br 弱 Br 弱
D.气态氢化物的还原性比硫化氢气体弱
参考答案:D
本题解析:略
本题难度:一般
5、填空题 X、Y 、Z、W是原子序数依次增大的四种短周期元素。已知X为非金属元素,且X与W同族。Y、Z为同周期的相邻元素,Y的氢化物分子中有3个共价键,Z原子最外层电子数是次外层电子数的3倍。W原子的质子数等于Y、Z原子的最外层电子数之和。请回答:
⑴四种元素的原子半径由大到小的顺序是?(填元素符号)
⑵比较Y和Z的气态氢化物的稳定性:?>?(填化学式)
⑶元素X和Z形成的化合物X2Z2,在MnO2存在的条件下,实验室用它来制取Z单质,写出反应方程式_____?
⑷由X、Y 、Z三种元素所形成的常见共价化合物是 ?,离子化合物是?。
⑸W的单质的化学式为?,其最高价氧化物的水化物中含有的化学键是?。
参考答案:(13分) ⑴? Na>N>O>H?⑵? H2O ; >; NH3
⑶ 2H2O2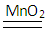 ?2H2O? + O2 ↑?(4)HNO3;NH4NO3?⑸? Na ;共价键、离子键 ?2H2O? + O2 ↑?(4)HNO3;NH4NO3?⑸? Na ;共价键、离子键
本题解析:Z原子最外层电子数是次外层电子数的3倍,所以Z是第二周期的氧元素。Y的氢化物分子中有3个共价键,这说明Y应该是第ⅤA族元素。Y、Z为同周期的相邻元素,且Y的原子序数小于Z的,所以根据短周期元素可知,Y是氮元素。W原子的质子数等于Y、Z原子的最外层电子数之和,则W的质子数=11,则W是钠元素。又因为X为非金属元素,且X与W同族,所以X是氢元素。
(1)同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,则四种元素的原子半径由大到小的顺序是Na>N>O>H。
(2)非金属性压强,氢化物的稳定性压强,则Y和Z的气态氢化物的稳定性是H2O>NH3。
(3)双氧水分解即生成氧气。
(4)由X、Y 、Z三种元素所形成的常见共价化合物是硝酸,离子化合物是硝酸铵。
(5)钠的最高价氧化物的水化物是氢氧化钠,含有离子键和极性键。
点评:该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
|