|
高考化学知识点整理《反应速率与平衡的有关计算》答题技巧(2017年最新版)(八)
2017-08-26 01:03:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  ?2NO2(g)? ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据: ?2NO2(g)? ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
 
| 0
| 20
| 40
| 60
| 80
| 100
| n(N2O?4)
| 0.40
| a
| 0.20
| c
| d
| e
| n(NO2)
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
|
(1)求b、e的值:b=?,e=?
(2)计算20s—40s内用N2O4表示的平均反应速率为?;80℃该反应的化学平衡常数K为?
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号)?。
A.向混合气体中再通入N2O4
B.保持容积不变,通入He
C.使用高效催化剂
D.降低温度
| (4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2)?0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
参考答案:(14分)(各2分)
(1)0.4,0.1
(2)0.002mol/(L?S);1.8
(3)AD
(4)大于
(5)见右图
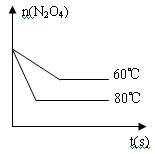
本题解析:略
本题难度:简单
2、选择题 恒温恒容的条件下,在密闭容器中按不同方式投入反应物,均达到平衡,测得平衡时的有关数据如下(已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol) 2NH3(g)△H=-92.4kJ/mol)

下列说法一定正确的是
[? ]
?①c1=c2?②c3=2c2?③Q1=?Q2?④Q1+Q2=92.4?⑤P1=P2?⑥a2>a3?
A.①④⑤⑥?
B.①③⑤⑥?
C.①②③⑥?
D.②③⑤⑥
参考答案:A
本题解析:
本题难度:一般
3、选择题 反应2SO2+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.4?mol/L,在这段时间内用O2表示的反应速率为0.04?mol·L-1·s-1,则这段时间为 2SO3(g)经一段时间后,SO3的浓度增加了0.4?mol/L,在这段时间内用O2表示的反应速率为0.04?mol·L-1·s-1,则这段时间为
[? ]
A.?0.1?s ?
B.?2.5?s ? ?
C.?5?s ?
D.?10?s
参考答案:C
本题解析:
本题难度:简单
4、填空题 在一定体积的密闭容器中,进行化学反应CO2 (g)+H2 (g) CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表: CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
t / ℃
| 700
| 800
| 830
| 1000
| 1200
| K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
?
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)正反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________(多选扣分)。
A、容器中压强不变? B、混合气体中c (CO)不变
C、v正(H2)=v逆(H2O)? D、c (CO2)="c" (CO)
(4)某温度下,平衡浓度符合下式:c (CO2)·c (H2)="c" (CO)·c (H2O)。可判断此时的温度为________℃。
参考答案:(1)
(2)吸热
(3)B、C
(4)830 w
本题解析:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以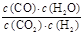 ;(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,(3)A、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故A错误;B、化学平衡时,各组分的浓度不随时间的改变而改变,故B正确;C、化学平衡状态的标志是v正=v逆,所以v正(H2)=v正(H2O)表明反应达到平衡状态,故D正确;D、c(CO2)=c(CO)时,表明正逆反应速率相等,达到了平衡状态,故D正确;(4)平衡浓度符合下式c(CO2)?c(CH2)=c(CO)?c(H2O)时,浓度熵和平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃。 ;(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,(3)A、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故A错误;B、化学平衡时,各组分的浓度不随时间的改变而改变,故B正确;C、化学平衡状态的标志是v正=v逆,所以v正(H2)=v正(H2O)表明反应达到平衡状态,故D正确;D、c(CO2)=c(CO)时,表明正逆反应速率相等,达到了平衡状态,故D正确;(4)平衡浓度符合下式c(CO2)?c(CH2)=c(CO)?c(H2O)时,浓度熵和平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃。
本题难度:一般
5、选择题 在一定条件下,对于反应:mA(g) + nB(g)  cC(g) +dD(g),C物质的质量分数(C%)与温度、压强的关系如图所示,下列判断正确的是?(?) cC(g) +dD(g),C物质的质量分数(C%)与温度、压强的关系如图所示,下列判断正确的是?(?)

A.△H<0△S>0
B.△H>0△S<0
C.△H>0△S>0
D.△H<0△S<0
参考答案:A
本题解析:先看清横纵轴:横轴表温度,纵轴表物质C的质量分数;
然后看线的走向:表示温度越高,物质C的质量分数越少,即:升温,平衡逆向移动,而升温时,平衡是向吸热反应的方向移动,则该反应的逆向吸热,则正向放热,故△H<0;
再做一条垂直于横轴的辅助线:表示在相同的温度下,压强越小,物质C的质量分数越大,即:减压,平衡正向移动,而减压时,平衡是向气体体积增大的方向移动,则该反应的正向是气体体积增大的方向,故m+n<c+d,所以△S>0
本题难度:一般
| 