| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《弱电解质电离平衡》试题特训(2017年最新版)(二)
参考答案:C 本题解析:根据NaHSO3+NaOH=Na2SO3+H2O,加入NaOH固体,溶液PH增大,A项错误;HSO3-的电离过程和水解过程都是吸热过程,温度升高,电离过程增大,水解程度增大,c(HSO3-)减小,B项错误;在同一溶液中,n(H+)?n(OH-)=C(H+)?c(OH-)V×V=KwV×V,加水稀释,KW不变,V增大,则加水稀释后,n(H+)与n(OH-)的乘积变大,C项正确;钠盐是强电解质,电离方程式为NaHSO3 = Na++HSO3-,D项错误;选C。 本题难度:一般 2、选择题 醋酸溶液中存在电离平衡:CH3?COOH→H++CH3?COO-,下列叙述不正确的是( ) 参考答案:A.醋酸溶液呈电中性,溶液中存在电荷守恒,即c(H+)═c(OH-)+c(CH3?COO-),故A正确; 本题解析: 本题难度:一般 3、选择题 下列叙述中,不正确的是 参考答案:D 本题解析:A、pH=2与pH=1的CH3COOH溶液中,c(H+)分别为0.01mol/L、0.1mol/L,所以c(H+)之比为1 :10,正确;B、根据质子守恒规律,水电离产生的H+与CO32-结合生成HCO3-和H2CO3,而水电离产生的H+与OH-浓度相等,所以c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),正确;C、仅含Na+、H+、OH-、CH3COO-离子的某溶液可能是醋酸钠溶液,所以不水解的离子的浓度最大,其次是水解离子,再次是显性离子,最后是不显性离子,醋酸钠溶液显碱性,所以c(Na+)>c(CH3COO-) >c(OH-)>c(H+),正确;D、CH3COOH为弱酸,在水溶液中部分电离,所以0.1mol/ L的CH3COOH溶液中的c(H+) ≠0.1mol/L,则由水电离出的c(H+) ≠1×10-13mol/ L,错误,答案选D。 本题难度:一般 4、选择题 pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列结论正确的是( ) |
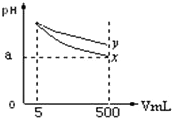
参考答案:C
本题解析:
本题难度:一般
5、选择题 25℃时,0.1mol/L稀醋酸加水稀释,右图坐标中的纵坐标y可以是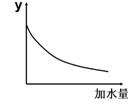
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液的导电能力
D.醋酸的电离程度
参考答案:C
本题解析:略
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《反应速率与.. | |