微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素。金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍。D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸。E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个。
(1)写出A元素名称:____________,C2粒子的符号:___________。
(2)画出E离子的结构示意图:_______________,E的氢化物的分子式_______________。
(3)写出B与E化合的化学方程式:________________________。
(4)写出A的单质、B的单质分别与水反应的溶液混合后发生的反应的离子方程式:____________________________________________。
(5)A与C形成的化合物中含化学键类型是:___________,用电子式表示该化合物的形成过程:_______________ 。?
参考答案:(1)氟;21H(2)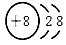 ;H2O
;H2O
(3)4Na+O2═2Na2O ,2Na+O2 Na2O2
Na2O2
(4)HF+OH-=F-+H2O
(5) 共价键(极性键);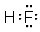
本题解析:
本题难度:一般
2、选择题 下列各组顺序的排列不正确的是( )
A.离子半径:Na+>Al3+>F-
B.热稳定性:HCl>PH3>AsH3
C.酸性:H3PO4>H2CO3>H2SiO3
D.熔点:CH3(CH2)3CH3>(CH3)2CHCH2CH3>CH3C(CH3)3
参考答案:A.电子层结构相同的离子,离子半径随着原子序数的增大而减小,Na+、Al3+、F-是电子层结构相同的离子,原子序数:铝>钠>氟,所以离子半径:F->Na+>Al3+,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,元素的非金属性:Cl>P>As,所以其氢化物的稳定性HCl>PH3>AsH3,故B正确;
C.元素的非金属性越强,其最高价含氧酸的酸性越强,元素的非金属性P>C>Si,所以其最高价含氧酸的酸性:H3PO4>H2CO3>H2SiO3,故C正确;
D.烷烃的同分异构体中,支链越多的烃其熔点越低,所以戊烷的同分异构体的熔点:CH3(CH2)3CH3>(CH3)2CHCH2CH3>CH3C(CH3)3,故D正确;
故选A.
本题解析:
本题难度:简单
3、填空题 如表是元素周期表的一部分:
族
?
I A
II A
III A
IV A
V? A
VI A
VII A
|
| 2 | ② | ③ | ④ | ? | ⑤ | ⑥ | ?
|
| 3 | ⑦ | ⑧ | ⑨ | ? | ⑩ |
|

|
(1)表中元素⑩的氢化物的化学式为______,此氢化物的还原性比元素
的氢化物的还原性______稳定性______(填强或弱)
(2)某元素的原子结构示意图为:

,在周期表位于______.该氢化物沸点比甲烷______.
(3)用电子式表示
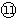
与⑧形成化合物形成过程:______.
(4)写出⑦与⑨、⑨与
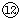
的最高价氧化物对应水化物反应的离子方程式:⑦与⑨:______、⑨与
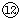
______.
参考答案:(1)⑩为P,其氢化物的化学式为PH3,
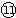
为S,非金属性S>P,则还原性PH3>H2S,气态氢化物H2S>PH3,故答案为:PH3;强;弱;
(2)K层电子数最多为2,则x=2,则原子结构中有3个电子层,最外层电子数为4,在元素周期表中的位置为第三周期第ⅣA族,气态氢化物的相对分子质量PH3>CH4,则PH3沸点高,
故答案为:第三周期第ⅣA族;高;
(3)
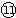
为S,⑧为Mg,形成的化合物为离子化合物,其形成过程为
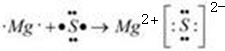
,故答案为:
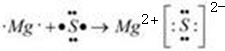
;
(4)⑦为Na,⑨为Al,
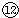
为Cl,NaOH与Al(OH)3反应的离子反应为OH-+Al(OH)3═AlO2-+2H2O,HClO4与Al(OH)3反应的离子反应为3H++Al(OH)3═Al3++3H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O;3H++Al(OH)3═Al3++3H2O.
本题解析:
本题难度:一般
4、选择题 下列关于元素周期表的说法正确的是( )
A.第ⅠA族的所有元素都是金属元素
B.原子序数为16的元素位于元素周期表的第3周期ⅥA族
C.稀有气体元素原子的最外层电子数均为8
D.第二周期ⅣA族元素的原子,其质子数和中子数一定都为6
参考答案:A.第ⅠA族包含碱金属与氢元素,碱金属都是金属元素,氢元素属于非金属性元素,故A错误;
B.原子序数为16的元素,该元素原子核外有3个电子层,最外层电子数为6,位于元素周期表的第3周期ⅥA族,故B正确;
C.氦原子只有1个电子层,核外电子数为2,其它稀有气体原子最外层电子数为8,故C错误;
D.第二周期ⅣA族元素的原子是C原子,12C中子数为6,14C中子数为8,故D错误;
故选B.
本题解析:
本题难度:一般
5、选择题 分别处于第二、三周期的主族元素A和B,它们的离子的电子层相差2层。已知A处于第m族;B处于第n族;A只有正化合价。则A、B原子核外电子总数分别为?
[? ]
A、m、n?
B、3、7?
C、m-2、10n?
D、m+2、n+10
参考答案:D
本题解析:
本题难度:简单