微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 表是元素周期表的一部分,回答下列有关问题:
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
4
⑩
|
(1)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)______,碱性最强的是______,呈两性的氢氧化物是______,
(2)写出工业上冶炼⑤的化学方程式为______;⑤与一种黑色晶体反应冶炼铁的化学方程式为:______.
(3)在⑧与⑦中,非金属性较强的元素是______,写出可以验证该结论的一个离子反应方程式______.
参考答案:由元素在周期表的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,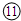 为Ca,
为Ca,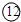 为Br,
为Br,
(1)最高价氧化物对应水化物中,Cl的最高价氧化物的水化物酸性最强,该酸为HClO4,K的最高价氧化物的水化物碱性最强,该碱为KOH,氢氧化铝为两性氢氧化物,该两性氢氧化物为Al(OH)3,故答案为:HClO4;KOH;Al(OH)3;
(2)电解法冶炼Al,该反应为2Al2O3(熔融)电解.冰晶石4Al+3O2↑;Al与四氧化三铁反应生成Fe,该反应为3Fe3O4+8Al高温.9Fe+4Al2O3,
故答案为:2Al2O3(熔融)电解.冰晶石4Al+3O2↑;3Fe3O4+8Al高温.9Fe+4Al2O3;
(3)Cl、S位于同周期,原子序数大的非金属性强,非金属性Cl>S,可利用非金属单质之间的置换反应说明,如Cl2+S2-=S↓+2Cl-,故答案为:Cl;Cl2+S2-=S↓+2Cl-.
本题解析:
本题难度:一般
2、简答题 某同学设计了如下一套实验方案探究同周期元素性质的递变规律.

(1)请将表中的实验方案与右表的实验现象进行配对.

(2)通过本探究实验,该同学得出第3周期元素金属性的递变规律是______.
参考答案:(1)钠为活泼金属,与冷水发生剧烈反应,由于钠的密度比水小,浮在水面上,钠的熔点较低,能迅速熔化成闪亮的小球,镁铝都是活泼金属,但镁的金属性较强,与盐酸反应较铝剧烈,
故答案为:实验方案1234实验现象BADC(2)通过以上实验现象可以看出,钠反应最剧烈,镁次之,铝最不活泼,所以可得出第3周期元素金属性的递变规律是逐渐减弱,
故答案为:从左到右金属性逐渐减弱.
本题解析:
本题难度:一般
3、简答题 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
1
① |
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
?⑩
|
(1)④、⑤、⑥的原子半径由大到小的顺序为______.
(2)⑨、=10 ⑩的最高价含氧酸的酸性由强到弱的顺序是______.
(3)①、④、⑥中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:______.
(4)由表中④、=10 ⑩两种元素形成的氢化物中沸点高的是______,说明原因:______.
参考答案:根据元素在周期表中的分布,可以知道①是H,②是C,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是Si,⑨是P,⑩是S.
(1)电子层越多半径越大,所以Na>O、F,电子层一样多的原子,核电荷数越多半径越小,即O>F,故答案为:Na>O>F;
(2)S、P是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:H2SO4>H3PO4,故答案为:H2SO4>H3PO4;
(3)H、O、Na中的Na和O元素组成的过氧化钠、氢元素和钠元素组成的氢氧化钠均是既含离子键又含共价键的化合物,电子式分别为:
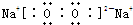
,
Na+
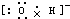
,故答案为:
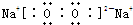
或Na+
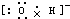
;
(4)水和硫化氢均是分子晶体,但是H2O分子间存在氢键,导致水的沸点高于硫化氢,故答案为:H2O;H2O分子间存在氢键.
本题解析:
本题难度:一般
4、选择题 A,B两种元素可形成AB型离子化合物,A,B两种离子的核外电子数之和为20,则两种元素所处的周期为
[? ]
A.在同一周期
B.一种在第一周期,一种在第二周期
C.一种在第二周期,一种在第三周期
D.一种在第三周期,一种在第四周期
参考答案:C
本题解析:
本题难度:简单
5、选择题 A、B、C、D、E均为短周期元素.A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3∶4.E原子半径是短周期元素原子半径最大的.则下列叙述正确的是
A.A和C能形成共价化合物
B.由B、D原子构成的分子的结构是正四面体
C.E和C只能形成E2C一种化合物
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
参考答案:A
本题解析:
本题难度:困难