微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列反应中,盐酸作氧化剂的是(?)
A.NaOH+HCl====NaCl+H2O
B.CaCO3+2HCl====CaCl2+CO2↑+H2O
C.Zn+2HCl====ZnCl2+H2↑
D.MnO2+4HCl(浓)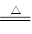 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
参考答案:C
本题解析:氧化剂在化学反应中有的元素化合价降低,A、B为复分解反应,D中HCl作还原剂。
本题难度:一般
2、实验题 (8分)50 mL1.0 mol·L-1盐酸跟50mL1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应。通过测 定反应过程中所放出的热量可计算中和热。试回答下列问题。
定反应过程中所放出的热量可计算中和热。试回答下列问题。
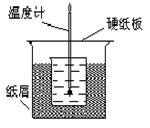
⑴大小烧杯间填满碎纸条的作用是什么?
⑵大烧杯上如不盖硬纸板,对求得中和热的数值有何影响?
⑶改用60 mL1.0mol·L-1盐酸跟50mL1.1mol·L-1氢氧化钠溶液进行反应,与上述实验相比,所测中和热的数值理论上是否相等(不考虑空气的影响)?简述理由。
⑷用相同浓度和体积的氨水代替NaOH溶液进行实验,为什么测得中和热的数值偏低?
参考答案:(每空2分,共8分)
⑴减少实验过程中的热量损失。
⑵因为热量损失,所得中和热数值偏低。
⑶所测中和热的数值相等。因为“中和热”是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关。
⑷因为氨水是弱碱,在中和过程中电离吸热,所以氨水和盐酸的中和热低于氢氧化钠和盐酸的中和热
本题解析:略
本题难度:一般
3、选择题 下列变化过程中表示的能量装化关系错误的是( )
A.植物光合作用:光能→生物质能
B.原电池:电能→化学能
C.木柴烧饭:生物质能→热能
D.太阳能热水器:光能→热能
参考答案:A.植物光合作用是光能转化为生物质能,故A正确;
B.原电池是化学能转化为电能,故B错误;
C.木柴烧饭是生物质能转化为热能,故C正确;
D.太阳能热水器是光能转化为热能,故D正确;
故选B.
本题解析:
本题难度:一般
4、填空题 (8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g) 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。
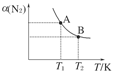
(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:
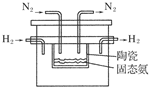
则阴极的电极反应式为____________________________________________________。
参考答案:(1)能"由于合成氨反应为可逆反应,10 mol N2和30 mol H2不可能完全反应,所以放出的热量小于10×92.4 kJ=924 kJ
(2)①40%"②0.082/(0.06×O.183)">"③b
(3)向左"(4)N2+6e-+6H+===2NH3
本题解析:(1)ΔH-TΔS=-92.4 kJ·mol-1-298 K×(-198.2 J·mol-1·K-1)×10-3 kJ·J-1=-33.3 kJ·moL-1<0,故该反应在298 K时能自发进行。由于合成氨反应为可逆反应,10 mol N2和30 mol H2不可能完全反应,所以放出的热量小于10×92.4 kJ=924 kJ。
(2)由反应:设转化了N2为x mol·L-1,
则 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
初始: 0.1 0.3 0
转化: x 3x 2x
平衡: 0.1-x 0.3-3x 2x
2x/(0.1-x+0.3-3x+2x)×100%=25%"x=0.04
所以①N2的转化率为:0.04/0.1×100%=40%。
②平衡常数KA=0.082/(0.06×0.183)。当温度由T1变化到T2时,N2的转化率降低,说明化学平衡向逆反应方向移动,所以KA>KB。③由于在恒容密闭容器中通入氩气,体系压强确实增大,但由于N2、H2、NH3的浓度均不发生变化,化学平衡不移动,故a错误;达到平衡时正、逆反应速率相等,即v(N2,正)=v(N2,逆)、v(H2,正)=v(H2,逆),由“化学反应速率之比等于化学方程式中化学计量数之比”知b正确;降低温度,化学平衡向正反应方向移动,气体物质的量减少,而气体总质量不变,根据M=m/n知,混合气体的平均相对分子质量增大,故c错误;增加N2的物质的量,化学平衡向正反应方向移动,H2的转化率升高,故d错误。
(3)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动。
(4)由于该反应的总式为合成氨反应:N2+3H2 2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。
2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。
本题难度:一般
5、选择题 下列属于放热反应的是
A.铝和盐酸反应
B.焦碳和二氧化碳共热
C.石灰石的分解
D.氢气还原氧化铜
参考答案:A
本题解析:A属于放热反应,活泼的金属与酸反应放热;B吸热,焦碳和二氧化碳共热在高温条件反应;C吸热反应,大多数的分解反应为吸热反应;D,吸热反应;
本题难度:简单