微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示晶体中,每个阳离子A或阴离子B均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为
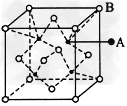
[? ]
A.AB
B.A2B
C.AB3
D.A2B3
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.碳酸氢根离子的电离方程式: HCO3-+H2O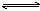 H3O++ CO32-
H3O++ CO32-
B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+
参考答案:A
本题解析:本题考查电离平衡、元素周期律及晶体结构知识;碳酸氢根,是弱酸酸式根,存在电离平衡,A正确;卤族元素从上到下,氢卤酸的酸性依次增强,B错误;非金属性强弱的判断,依据最高价氧化物对应水化物酸性强弱,HClO不是最高价含氧酸,不能做为判断的依据,C错误;CsCl晶体中每个Cl-同时吸引着8个Cs+,D错误。
本题难度:一般
3、选择题 关于晶体和化学键关系的下列说法中,正确的是
参考答案:C
本题解析:
正确答案:C
A不正确,NaCl晶体中只有离子键;B、不正确,原子晶体中只有共价键;C、正确;D、稀有气体为单原子分子,没有共价键。
本题难度:一般
4、填空题 氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物。
(1)NF3的沸点为-129℃,其分子的空间构型为____________。
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-。
①与N3-互为等电子体的分子、离子有____________(各举1例)。
②叠氮化物、氰化物都能与Fe2+、Cu2+及Co3+等形成配合物,如:[Fe(CN)6]4-、[Co(N3)(NH3)5]SO4。铁的基态原子核外电子排布式为________________;CN-中C原子的杂化类型是_________;[Co(N3)(NH3)5]SO4中钴的配位数为_______________。
③NaN3与KN3的结构类似,则NaN3的晶格能________KN3的晶格能。(填“>”或“<”)
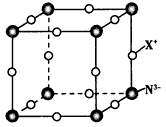
(3)元素X与N形成的氮化物中,X+中的所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如上图所示。则X+符号是________,每个N3-与其距离最近的X+有_________个。
参考答案:(1)三角锥形
(2)①N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-;②[Ar]3d64s2;sp杂化;6;③>
(3)Cu+;6
本题解析:
本题难度:一般
5、选择题 碘的熔、沸点较低,其原因是(?)
A.碘的非金属性较弱
B.I2分子中I-I共价键较弱
C.碘原子半径较大
D.碘分子间以分子间作用力相结合
参考答案:D
本题解析:单质碘形成的晶体是分子晶体,碘分子间以分子间作用力相结合,所以碘的熔、沸点较低,答案选D。
点评:本题是基础性试题的考查,侧重对学生基础知识的检验,难度不大。该题需要明确的是物质熔沸点大小与物质形成的晶体类型关系密切,所以准确判断出物质的晶体类型是解答好该类试题的关键。
本题难度:简单