微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式正确的是
A.铜溶于浓硝酸:Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑+ 2H2O
B.氯化铝溶液与过量氨水反应:Al3++4NH3·H2O= [Al(OH)4]-+4NH4+
C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
参考答案:A
本题解析:A.原理、拆写合理。制取。B.一水合氨是弱电解质,不能溶解氢氧化铝。离子方程式应该为:Al3++3NH3·H2O= Al(OH)3↓+3NH4+.错误。C.HClO是弱酸,应该写化学式。离子方程式为Cl2+H2O=H++Cl-+HClO。错误。D.HClO有氧化性,会把CaSO3氧化为CaSO4。离子方程式一个写作:SO2+H2O+Ca2++ClO-=CaSO4↓+2H++Cl-。错误。
本题难度:一般
2、选择题 下列反应的离子方程式,书写正确的是( )
A.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
B.H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O
C.氢氟酸与氢氧化钠溶液反应:H++OH-=H2O
D.小苏打溶液跟烧碱溶液反应:HCO3-+OH-=CO32-+H2O
参考答案:A.把金属铁放入稀硫酸中的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.H2SO4溶液中滴入Ba(OH)2溶液的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.氢氟酸与氢氧化钠溶液反应的离子反应为HF+OH-=H2O+F-,故C错误;
D.小苏打溶液跟烧碱溶液反应的离子反应为HCO3-+OH-=CO32-+H2O,故D正确;
故选D.
本题解析:
本题难度:简单
3、填空题 化学科学在药物的开发、合成和使用中起着至关重要的作用.如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血.试回答下列问题:
(1)写出小苏打与胃酸作用的离子方程式:______.
(2)现有一瓶胃舒平药片(复方氢氧化铝),请设计实验验证其主要成分.(写出实验步骤和实验现象):将药片碾碎,______,则说明其主要成分为氢氧化铝.
(3)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:______.
参考答案:(1)小苏打为碳酸氢钠,与盐酸反应生成氯化钠、水和二氧化碳,离子反应为HCO3-+H+═CO2↑+H2O,
故答案为:HCO3-+H+═CO2↑+H2O;?
(2)因氢氧化铝具有两性,则取少量碾碎的药片粉末溶解到过量稀盐酸中,过滤,取滤液少许,并向其中逐滴加入氢氧化钠溶液,若先出现白色沉淀,后沉淀溶解,可说明主要成分为氢氧化铝,
故答案为:取少量碾碎的药片粉末溶解到过量稀盐酸中,过滤,取滤液少许,并向其中逐滴加入氢氧化钠溶液,若先出现白色沉淀,后沉淀溶解;
(3)氯气可将亚铁离子氧化为铁离子,离子反应为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
本题解析:
本题难度:一般
4、选择题 化学用语是学习化学的重要工具.以下化学用语表示错误的是( )
A.质量数之和是质子数之和两倍的水分子符号可能是:
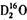
B.NaHCO3水溶液呈碱性的原因:

C.硫离子的电子排布式:
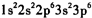
D.熔融状态下硫酸氢钠的电离方程式:
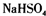
(熔融)═
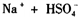
参考答案:A、
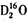
中质子数为10,原子质量数之和为16+4=20,质量数之和是质子数之和的2倍,故A正确;
B、NaHCO3水溶液呈碱性的原因是碳酸氢根的水解程度大于电离程度,题目中是碳酸氢根的电离,故B错误;
C、硫离子核外有18个电子,核外电子排布式为1s222s2p63s23p6,故C正确;
D、硫酸氢钠是由钠离子与硫酸氢根离子构成的离子化合物,熔融下电离出钠离子与硫酸氢根离子,故D正确.
故选B.
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/LHA溶液的pH>1,0.1mol/LBOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
参考答案:A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,说明水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,酸性条件下AlO2-不能大量存在,故A错误;
B.常温时,0.1mol/LHA溶液的pH>1,说明HA不能完全电离,为弱酸,0.1mol/LBOH溶液中c(OH-)/c(H+)=1012,则c(OH-)=0.1mol/L,说明BOH为强碱,二者等体积混合,完全反应生成BA,为强碱弱酸盐,溶液呈碱性,则c(OH-)>c(H+),一般来说单水解的程度较低,则有c(A-)>c(OH-),应为(B+)>c(A-)>c(OH-)>c(H+),故B错误;
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:3SO2+2NO3-+Ba2++2H2O=BaSO4↓+2NO↑+4H++2SO42-,故C错误;
D.如为pH=3和pH=2的盐酸中和NaOH溶液,则有Va=10Vb,但醋酸为弱电解质,浓度越小,电离程度越大,所以应有Va>10Vb,故D正确.
故选D.
本题解析:
本题难度:一般