| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡状态的判断》考点强化练习(2017年押题版)(二)
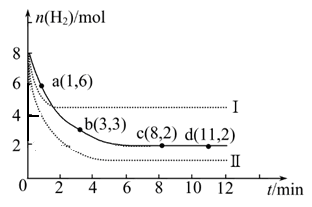 ① a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”)。 ② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是 ?,曲线Ⅱ对应的实验条件改变是 ? ? 。 ③ 在题给图中绘出加入催化剂对应的曲线。 ④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程) (3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:?。 参考答案:(16分) 本题解析:(1)各组分变化的物质的量之比等于化学方程式中的系数之比,平衡时物质的量之比不一定等于系数之比,故A选项错误;正反应是气体物质的量减小的方向,因此从正反应开始进行时,容器内气体物质的量逐渐减小,压强逐渐减小,若压强保持不变,说明气体总的物质的量保持不变,反应已达平衡,故B选项正确;氢气是反应物,其消耗速率为v正(H2),甲醇是生成物,其消耗速率为v逆(CH3OH),二者之比等于化学方程式中相应的系数之比,说明反应已达平衡,故C选项正确;各组分都是气体,则容器内气体的总质量和容器的体积都保持不变,因此容器内气体的密度始终不变,不能说明反应已达平衡,故D选项错误;(2)①氢气是反应物,从正反应开始进行时,其物质的量逐渐减小,a点表示氢气的物质的量还没有达到极限,还能继续减小,说明此时反应还在向正反应方向进行,所以v正(H2)> v逆(H2);②读图可得,曲线I先达到平衡,且平衡时氢气的物质的量比原平衡大,说明采取的条件既能增大反应速率,又能使平衡向逆反应方向移动,根据外界条件对反应速率和平衡移动的影响规律推断,只有升高温度才能得到曲线I,因为正反应是放热反应;只有增大压强才能得到曲线II,因为正反应是气体体积减小的方向;③无催化剂变为有催化剂,只能加快反应速率,缩短达到平衡的时间,不能使平衡移动,不能改变氢气起始时和平衡时的物质的量,由此可以画出加入催化剂时氢气的物质的量随反应时间变化的示意图,并作出必要的标注;④用三行数据法和定义式求平衡常数,则: 本题难度:困难 3、选择题 在一定温度下,可逆反应A2(g)+B2(g)? 参考答案:A、容器内各组分的浓度不随时间的变化而变化,就说明了该反应达到平衡状态,故A正确; 本题解析: 本题难度:一般 4、选择题 在一恒温、恒容的密闭反应器中发生如下反应:C(s)+H2O?CO(g)+H2(g),为了判定该可逆反应是否达到平衡,没有参考价值的物理量是( ) 参考答案:A.该反应是一个反应前后气体增大的可逆反应,反应前后气体的体积改变,所以能作为化学平衡状态的判断依据,故A不选; 本题解析: 本题难度:简单 5、选择题 己知反应A(g) + B(g)
A.达到平衡后,B的转化率为50% B.增大压强,正、逆反应速率均加快 C.该反应为吸热反应,升高温度,平衡正向移动 D.反应初始至平衡,A的平均反应速率v(A) = 0.005 mol·L-1·s-1 参考答案:C 本题解析:设平衡时参加反应的B的物质的量为xmol,则: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《硝酸》试题.. | |