微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)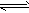 2NH3(g)反应的图象中,错误的是
2NH3(g)反应的图象中,错误的是
[? ]
A. 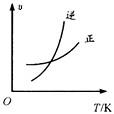
B. 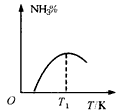
C. 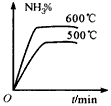
D. 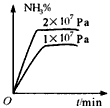
2、填空题 在某一容积为2?L的密闭容器内,加入0.8?mol的H2和0.6?mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)? 2HI(g) ΔH<0 反应中各物质的浓度随时间变化情况如图所示:
2HI(g) ΔH<0 反应中各物质的浓度随时间变化情况如图所示:

(1)该反应的化学平衡常数表达式为________.
(2)根据图所示数据,反应开始至达到平衡时,平均速率v(HI)为________.
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K________(填写增大、减小或不变),HI浓度的变化正确的是________(用右图中a~c的编号回答).
②若加入I2,H2浓度的变化正确的是________(用右图中d~f的编号回答).
3、填空题 如图,一定温度下,分别往容积均为?5L?的甲(恒压容器)、乙(恒容容器)中加入?0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到?2s时,测得乙容器中N2O4的浓度为?0.09mol?L-1.经过?60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是:______.
(2)前?2s内乙容器中以N2O4的浓度变化表示的反应速率为______.
(3)达到平衡时,甲容器中反应所需的时间______?60s(填“大于”、“小于”或“等于”,以下同);容器内N2O4的浓度甲______?乙;反应过程中吸收的能量甲______?乙.
4、填空题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:_________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:______________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)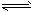 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)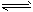 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)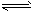 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)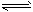 CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)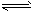 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
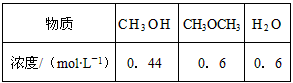
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率
v(CH3OH) = __________。
5、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)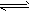 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
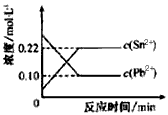
下列判断正确的是
[? ]
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2