微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100 mL6 mol/L的盐酸,烧杯乙中盛放100 mL冷水。现向烧杯甲的溶液中放入7.2 g镁条,同时向烧杯乙中放人10 g NH4Cl和20 g氢氧化钡晶体,搅拌使之溶解。
 ?
?
(1)A瓶中气体颜色?,理由是?;
(2) B瓶中气体颜色?,理由是?;?
参考答案:(8分)(1)变深? Mg与盐酸反应放热,所以A中气体温度升高。2NO2 N2O4(正反应为放热反应),平衡向左移动,NO2浓度增大,颜色加深;
N2O4(正反应为放热反应),平衡向左移动,NO2浓度增大,颜色加深;
(2)变浅? NH4Cl与晶体氢氧化钡反应吸热,使B中气体温度降低,上述平衡向右移动,NO2浓度减小,颜色变浅。
本题解析:考查反应与能量的关系、温度对化学平衡的影响
对于可逆反应2NO2(红棕色) N2O4(无色),正反应是放热反应
N2O4(无色),正反应是放热反应
(1)金属与酸的置换反应为放热反应,升温使平衡左移,NO2的浓度增大,红棕色加深
(2)NH4Cl与氢氧化钡晶体在常温下发生吸热反应,降温使可逆反应正向移动,NO2浓度减小,颜色变浅
本题难度:简单
2、实验题 为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究。请回答下列问题:
 ?(一)甲组:实验方案:镁铝合金
?(一)甲组:实验方案:镁铝合金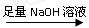 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的NaOH溶液,不断搅拌,充分反应。发生反应的离子方程式为?
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将?(填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体
 ?(二)乙组:实验方案:镁铝合金
?(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积
实验装置如右下图
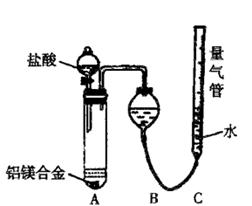
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置。你的意见是?(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点)?、
?
(三)丙组:实验方案:12 g镁铝合金
操作l包括过滤、洗涤、干燥和称量, 并最终得到固体物质1.45g。则该合金中铝的质量分数为?。
并最终得到固体物质1.45g。则该合金中铝的质量分数为?。
参考答案:(一)2Al  +2OH- + 6H2O = 2[Al(OH)4]-? + 3H2↑ (2分)
+2OH- + 6H2O = 2[Al(OH)4]-? + 3H2↑ (2分)
(或2Al +2OH- + 2H2O =" 2Al" O2— + 3H2↑)
偏低(1分)
(二)不需要(1分)
保持装置的气密性良好;调节量气管C的高度使C中液面与B中液面相平再读数;冷却至室温再读数;读数时视线应与凹液面最低处相平等合理答案均可
(要求写出二点,每点1分,共2分)
(三)95%?(3分)
本题解析:略
本题难度:简单
3、实验题 某研究性学习小组探究甲醛与新制的氧化铜反应的产物。 ?
【实验操作】取一支试管,加入2mL20﹪的氢氧化钠溶液,滴入4滴饱和硫酸铜溶液,再加入2mL?37%~40%的甲醛溶液,振荡后放入60℃左右的热水浴中加热。 ?
【实验现象】溶液变浑浊,有暗红色固体生成,且有气泡产生。 ?
Ⅰ探究暗红色固体的成分. ?
【提出假设】?
假设l:暗红色固体为Cu ?
假设2;暗红色固体为Cu2O ?
假设3:暗红色固体为____________________________。
【查阅资料】Cu2O能溶解于氨水,形成无色溶液,并很快被空气中氧气氧化为蓝色溶液;
Cu不能溶解于氨水。
【实验验证】

Ⅱ探究气体产物X的成分。为进一步探究实验中气体产物X的成分,甲同学按相同比例取较多量试剂从新进行实验,并将产生的气体通入下列装置中

实验中,A装置中没有明显现象,C装置中黑色粉末变红,D装置中溶滚变浑浊,可以推断气体产物X含有_________________(填化学式)。 ?
【思考与交流】?
(1)A装置的作用有_________________?和_________________。 ?
(2)乙同学提出,上述装置有明显的不足,请你指出该不足之处________________
(3)丙同学提出:在该实验条件下,气体产物X中不可能含有CO2。你认为他的理由是_________________________________。
参考答案:Ⅰ假设3:Cu 和Cu2O
实验验证:固体部分溶解,溶液很快变蓝色
ⅡCO ;
思考与交流:(1)检验气体中是否含有CO2;除去可能挥发出的HCHO蒸气?
(2)没有尾气处理装置;(3)反应液呈碱性,不可能有CO2气体溢出
本题解析:
本题难度:一般
4、实验题 (14分)
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)? ①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2)?用改正后的装置进行实验.实验过程如下:
实验操作
| 实验现象
| 结论
|
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯
| D装置中:溶液变红
E装置中:水层溶液变黄振荡后CCl4层无明显变化
| Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
______________________
|
(3)?因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深最后变成红色。为探究上述实验现象的本质,小组同学查得资料如下:
Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2.
Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应.
Ⅲ.AgClO、AgBrO均可溶于水.
|
①?请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因___________________,请设计简单实验证明上述解释:______________________
②?欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因_______________________________________________
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为:___________________
参考答案:(1)①关闭活塞A,打开止水夹B,将长导管末端浸入水中,用手捂住圆底烧瓶,管口有气泡产生;松开手后,有水进入导管,则气密性良好。②缺少尾气处理装置。
(2)Cl2> Br2 > Fe3+
(3)①过量氯气和SCN-反应:2SCN-+Cl2=2Cl+(SCN)2,,使SCN- 浓度减小,则使Fe3+
+3SCN- ="=" Fe(SCN)3平衡向逆反应方向移动而褪色。
检验方法为:取少量褪色后的溶液,滴加KSCN?溶液,若溶液变红色,则上述推理合理;或取少量褪色后的溶液,滴加Fe Cl3溶液,若溶液不变红,则上述推理合理
②BrCl+H2O=HBrO反应产生 Cl-由于AgBrO易溶于水,加入 AgNO3溶液,只能生成AgNO3沉淀
③BrCl+2KI=KCl+KBr+I2
本题解析:(1) ②氯气有毒不能直接排空,且如果氯气有剩余会导致D和E装置中气体压强增大,导致安全事故的发生,所以该实验装置的缺点为:缺少尾气处理装置。
(2)D装置中:溶液变红,说明有铁离子生成,据此得出氯气的氧化性大于铁离子;
E装置中:水层溶液变黄,振荡后CCl4层无明显变化,说明氯气和溴离子不反应,
根据D和E装置知,溴的氧化性大于铁离子,则氧化性强弱顺序是?Cl2>Br2>Fe3+,
本题难度:一般
5、简答题 碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用.甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答.
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如图1:

①溶解大理石时,用硝酸而不用硫酸的原因是______.
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、______、______.
③“滤液A”中除H+离子外,还含有的阳离子是______;检验该阳离子的实验方法是:取少量滤液A与______在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可.
(2)乙组对某硫酸钙晶体(xCaS04?yH20)加热分解的有关反应进行探究.他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如图2所示.又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:2CasO4
2CaO+2S02↑+O2↑.
①加热时,该晶体开始发生化学变化的时间是______(填“t1”、“t3”或“t5”).
②t4~t5时间段固体的化学式为______.
③tl~t2时间段固体发生反应的化学方程式为______.
参考答案:(1)①硫酸和碳酸钙反应生成的硫酸钙是微溶于水的物质,附着在大理石表面阻止反应进行,所以选择硝酸反应;
故答案为:硫酸钙微溶于水;
②上述流程中,“分离”得产品为碳酸钙沉淀和硝酸铵溶液,所包含的实验操作依次为过滤,洗涤,干燥;
故答案为:洗涤,干燥;
③大理石与硝酸反应后生成硝酸钙,硝酸铁,加入一水合氨反应生成氢氧化铁沉淀,滤液中加入碳酸铵反应生成碳酸钙沉淀,过滤得到碳酸钙,滤液中含有阳离子为氢离子,铵根离子;依据铵根离子的检验方法是和氢氧化钠反应生成氨气,遇到湿润的红色石蕊试纸变蓝证明氨气的生成;
故答案为:NH4+,烧碱;
(2)①依据图象分析,固体质量在0-t1时间段无变化,说明固体未反应,加热到t1时,固体质量开始减小,所以该晶体开始发生化学变化的时间是t1;
故答案为:t1;
②在加热到t1时xCaSO4?yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,t4~t5时间段固体的化学式为CaSO4;
故答案为:CaSO4;
③t3~t4时间段完全脱水,则m(H2O)=6.52g-5.44g=1.08g,m(CaSO4)=5.44g,n(H2O)=1.08g18g/mol=0.06mol,n(CaSO4)=5.44g136g/mol=0.04mol,所以n(CaSO4):n(H2O)=x:y=0.04:0.06=2:3,化学式为:2CaSO4?3H2O,tl~t2时间段固体质量变化,减少水的质量=6.52g-5.80g=0.72g,n(H2O)=0.72g18g/mol=0.04mol;固体质量为5.80g,6.52g硫酸钙固体物质的量=6.52g326g/mol=0.02mol,则1mol2CaSO4?3H2O失水2mol,反应的化学方程式为:2CaSO4?3H2O△.2CaSO4?H2O+2H2O,
故答案为:2CaSO4?3H2O△.2CaSO4?H2O+2H2O.
本题解析:
本题难度:简单