微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某密闭容器中通入a mol NO和b mol O2,发生反应:2NO+O2=2NO2,反应后容器内氮原子和氧原子之比为
A.a:b
B.a:(a+2b)
C.a:2b
D.a:2(a+b)
参考答案:B
本题解析:分析:根据原子守恒:化学反应前后原子总数不变(不管如何反应,以及反应是否完全)来回答.
解答:反应前N原子总数是amol(全部在NO中),O原子总数是(a+2b)mol(NO中有O原子,O2中也有O原子),根据原子守恒:反应后原子个数不变,所以氮原子和氧原子个数之比=a:(a+2b).
故选B.
点评:本题考查学生原子守恒思想在反应中的应用知识,较简单.
本题难度:简单
2、选择题 如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.R的单质能与W的氢化物反应,可证明非金属性:R>W
B.最高正价氧化物对应的水化物的酸性:RC.X与Z组成的化合物是共价化合物,且又具有两性
D.离子半径:Z>Y>X
参考答案:A
本题解析:试题分析:结合图像与短周期元素化合价,可知X为O,Y为Na,Z为Al,W为S,R为Cl。Cl2可与H2S反应,生成S,说明非金属性Cl>S,A正确;Cl、S的最高价氧化物对应水化物分别为HClO4、H2SO4,酸性HClO4>H2SO4,B错;O与Al形成的Al2O3是离子化合物,C错;O、Al、Na的单原子离子电子层结构相同,核电荷数越大,离子半径越小,因此离子半径O>Na>Al,D错。
考点:考查元素周期律和常见元素化合物性质。
本题难度:简单
3、选择题 几种短周期元素的原子半径及主要化合价如下表
A.R的氧化物对应的水化物可能具有两性
B.X单质在氧气中燃烧不可能生成XO3
C.离子半径大小:r(M3+)>r(T2-)
D.最高价氧化物对应水化物碱性:L(OH)2>M(OH)3
参考答案:C
本题解析:L、M、X、R、T对应的元素分别为: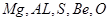 所以
所以
A正确,氢氧化铍具有两性;B正确,S单质燃烧不能生成三氧化硫;C错,离子半径大小关系为:r(T2-)>r(M3+);D正确;镁的金属性比铝强;
本题难度:困难
4、选择题 用水就能鉴别的一组物质是
A.苯乙醇四氯化碳
B.乙醇乙醛乙酸
C.乙醛乙二醇硝基苯
D.苯酚乙醇甘油
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列离子方程式正确的是
A.钠与水反应Na+2H20=Na++20H-+H2↑
B.用食醋除去热水瓶胆中Mg(OH)2水垢2H++Mg(OH)2=Mg2++2H20
C.将少量SO2?气体通人?NaClO?溶液中?SO2+2C10-+H2O=SO32++2HC10
D.在硫酸氢钾溶液中加人氢氧化钡溶液至pH=7?Ba2++20H-+2H++SO42-=BaSO4↓+2H20
参考答案:D
本题解析:分析:A、选项中离子方程式电荷不守恒;
B、醋酸是弱酸存在电离平衡;
C、二氧化硫具有还原性,次氯酸根离子具有氧化性,二者发生氧化还原反应;
D、在硫酸氢钾溶液中加人氢氧化钡溶液至pH=7氢氧根离子和氢离子恰好反应,物质按照1:1反应;
解答:A、钠与水反应的离子方程式为:2Na+2H20=2Na++20H-+H2↑,故A错误;
B、用食醋除去热水瓶胆中Mg(OH)2水垢:2CH3COO-+Mg(OH)2=Mg2++2H20,故B错误;
C、ClO-有较强的氧化性,而在水溶液中SO2有较强的还原性,二者相遇首先发生氧化还原反应,生成氯离子和硫酸根离子.由于硫酸钙水中溶解度不大,硫酸根离子与钙离子又会形成硫酸钙沉淀,反应的离子方程式为:SO2 +ClO-+Ca2++H2O=CaSO4↓+Cl-+2H+,故C错误;
D、在硫酸氢钾溶液中加人氢氧化钡溶液至pH=7,氢离子和氢氧根离子恰好反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++20H-+2H++SO42-=BaSO4↓+2H20;故D正确;
故选D.
点评:本题考查了离子方程式的书写方法和注意问题,反应原理的理解,电荷守恒的应用,氧化还原反应的判断是解题关键,题目难度仔细点.
本题难度:一般