微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)某温度下1L密闭容器中加入1molN2和3molH2,使反应N2+3H2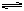 ?2NH3达平衡,测得混合气体中N2、H2、NH3的量分别为m、n、gmol,如温度不变,只改变初始物质的加入量,而要求m、n、g总保持不变。若N2、H2、NH3的起始加入量用x、y、z表示时,应满足条件:
?2NH3达平衡,测得混合气体中N2、H2、NH3的量分别为m、n、gmol,如温度不变,只改变初始物质的加入量,而要求m、n、g总保持不变。若N2、H2、NH3的起始加入量用x、y、z表示时,应满足条件:
(1)若x=0,y=0时z= __?__mol,
(2)若x=0.25mol,则y= ___?_mol,z= __?__mol,
(3)x、y、z应满足的一般条件是(用含x、y、z的代数式表示)?。
参考答案:(1)2,(2) 0.75,1.5,(3)x + z/2 =1,y + 3z/2 = 3
本题解析:反应是体积减小的可逆反应,保持体积不变,要使平衡等效,则必须保证最初的投料是相等的。最初是1mol氮气和3mol氢气,则根据化学方程式换算后的氢气和氮气也必须是3mol和1mol,即x + z/2 =1,y + 3z/2 = 3。
本题难度:一般
2、选择题 与自然界中的许多变化一样,化学反应具有方向性。下列有关叙述中正确的是
A.原电池反应一定是自发进行的氧化还原反应,且△H<0
B. ΔH<0,ΔS<0的反应肯定能自发进行
C.体系能量增大和混乱度增大都有促使反应自发进行的倾向
D.CaCO3(s) =CaO(s)+CO2(g)的ΔH>0,ΔS<0,该反应在较高温度下能自发进行
参考答案:A
本题解析:根据△G=△H-T·△S可知,ΔH<0,ΔS<0的反应不一定能自发进行,B不正确。放热反应才有利于反应的自发进行,C不正确。根据△G=△H-T·△S可知,当ΔH>0,ΔS<0时,反应在较低温度下能自发进行,D不正确。答案选A。
本题难度:简单
3、填空题 在与外界隔离的体系中,自发过程将导致体系的________增大,这个原理也叫做________原理。在用来判断过程的方向时,就称为________判据。不难理解,即使是同一物质,应该存在着________时的熵值最大,________时次之,________时最小的这样一种普遍规律。
参考答案:熵;熵增;熵;气态;液;固
本题解析:
本题难度:一般
4、选择题 在一定条件下,对于反应mA(g)+nB(g)≒cC(g)+dD(g), C物质的浓度(c%)与温度、压强的关系如图所示。
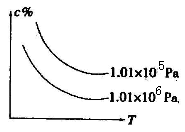
下列判断正确的是(?)
A.△H<0、△S>0
B.△H<0、△S<0
C.△H>0、△S>0
D.△H>0、△S<0
参考答案:A
本题解析:由曲线图可知,增大压强,C%减少,即增大压强平衡向逆反应方向移动,所以逆反应为气体体积减小的反应,即 ;升高温度C%减少,即升高温度平衡向逆反应方向移动,即正反应为放热反应;正确选项为A;
;升高温度C%减少,即升高温度平衡向逆反应方向移动,即正反应为放热反应;正确选项为A;
本题难度:一般
5、选择题 A、B、C、D四种物质皆易溶于水,且在水溶液中存在如下化学平衡,加水稀释后,平衡向正反应方向移动的是……( )
A、A+B C+D B、A+H2O
C+D B、A+H2O C+D C、A+B
C+D C、A+B C+H2O D、A+2B+H2O
C+H2O D、A+2B+H2O C
C
参考答案:B
本题解析:首先注意到所加水属于纯液体,固体和纯液体的量的增减对化学平衡移动是没有影响的,但加水可以改变其它物质的浓度,从而影响化学平衡。A选项,加水稀释A、B、C、D均为相同倍数,故平衡不移动。B选项,A与C、D各稀释相同倍数,C、D为生成物两种浓度的减小,大于A物质(反应物)浓度的减小,利用勒夏特列原理,平衡右移。同样道理,C、D两个选项,平衡均左移。
本题难度:一般