| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《盐类水解的原理》试题特训(2017年最新版)(十)
参考答案:A 本题解析: 本题难度:一般 2、选择题 下列表示水解反应的离子方程式中,正确的是( ? ) 参考答案:C 本题解析: 本题难度:简单 3、选择题 HA为酸性略强于醋酸的一元弱酸.在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是 |
参考答案:C
本题解析:HA为酸性略强于醋酸的一元弱酸,NaA就是强碱弱酸盐,水解溶液显碱性c(OH-) > c(H+),A错;A-水解程度很小则c(A-) >c(OH-),B错;C是电荷守恒,对; D.应该是c(Na+)+c(OH-) >c(A-)+c(H+),D错。选C。
考点:溶液中离子浓度的大小比较和电荷守恒。
本题难度:一般
4、选择题 用0.10mol·L-1的盐酸滴定0.10mol·L-1的氨水,滴定过程中不可能出现的结果是
A.c( )>c(Cl-),c(OH-)>c(H+)
)>c(Cl-),c(OH-)>c(H+)
B.c( )=c(Cl-),c(OH-)=c(H
)=c(Cl-),c(OH-)=c(H
C.c(Cl-)>c( ),c(OH-)>c(H+)
),c(OH-)>c(H+)
D.c(Cl-)>c( ),c(H+)>c(OH-)
),c(H+)>c(OH-)
参考答案:C
本题解析:A、若滴定后溶液中的溶质为氯化铵和一水合氨,则一般溶液显碱性,即c(OH-)>c(H+),溶液中弱电解质的电离>盐的水解,即c(NH4+)>c(Cl-),则符合电荷守恒,故A是可能出现的结果;B、若滴定后溶液中的溶质为氯化铵和一水合氨,当溶液中弱电解质的电离程度与盐的水解程度相同时,溶液为中性,则c(OH-)=c(H+),由电荷守恒可知c(NH4+)=c(Cl-),故B是可能出现的结果;C、当c(Cl-)>c(NH4+),c(OH-)>c(H+),则溶液中阴离子带的电荷总数就大于阳离子带的电荷总数,显然与电荷守恒矛盾,故C是不可能出现的结果;D、若滴定后溶液中的溶质为氯化铵,由铵根离子水解则溶液显酸性,即c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+),且符合电荷守恒,故D是可能出现的结果。
考点:本题考查弱电解质的电离、盐类的水解、离子浓度比较。
本题难度:困难
5、选择题 在相同温度下,在pH都是9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为amol/L与bmol/L,则a与b的关系为
A.a>b
B.a=10-4b
C.b=10-4a
D.a=b
参考答案:B
本题解析:虽然两种溶液PH均等于9,即两种溶液中c(H+)均等于10-9mol/L,但由水电离出来的c(H+)或c(OH-)就不相等了。根据H2O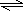 H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,CH3COONa促进水的电离.假设“在相同温度下”该温度为常温,NaOH抑制水的电离,则由水电离出的c(H+)水=c(OH-)水<10-7mol/L,即a<10-7;CH3COONa促进水的电离,则由水电离出的c(H+)水=c(OH-)水>10-7mol/L,即b>10-7,由此可知,a<b,根据题目的四个选项,只有B符合a<b,故答案为B
H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,CH3COONa促进水的电离.假设“在相同温度下”该温度为常温,NaOH抑制水的电离,则由水电离出的c(H+)水=c(OH-)水<10-7mol/L,即a<10-7;CH3COONa促进水的电离,则由水电离出的c(H+)水=c(OH-)水>10-7mol/L,即b>10-7,由此可知,a<b,根据题目的四个选项,只有B符合a<b,故答案为B
考点:电离平衡与溶液的pH值
点评:注意应用排除法做题,本题没有说常温下,如果计算是不能得出a=10-4b的,但能知道a 、b 的大小关系,结合选项即可得出答案。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《硫及其化合.. | |