| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《盐类水解的原理》试题特训(2017年最新版)(二)
A.用坩埚灼烧MgCl2?6H2O的反应式?MgCl2?6H2O  MgCl2+6H2O MgCl2+6H2OB.根据表中提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一 D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)?c(SO42-).则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d?点变到c?点 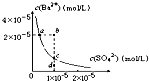 参考答案:B 本题解析: 本题难度:一般 2、填空题 (10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题: 参考答案:(每空2分,共10分) (1)16 (2)FeCl3电离出的Fe3+在水溶液中发生水解,使溶液显酸性。Fe3++3H2O 本题解析:(1)根据方程式可知氧化剂只有氧气,消耗3molFeS2,转移8mol×4=32mol,所以该过程中若有1.5mol FeS2参加反应,则反应过程中转移16mol电子。 本题难度:一般 3、选择题 将标准状况下的2.24LCO2通入150mL1mol/LNaOH溶液中,下列说法正确的是 参考答案:A 本题解析: 本题难度:困难 4、选择题 常温下,0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是( ) |
参考答案:B
本题解析:
正确答案:B
A.不正确,溶液中由水电离产生的H+浓度小于1×10-7 mol·L-1
B.正确,物料守恒:①c(CH3COO-)+c(CH3COOH)=2c(Na+)=0.10 mol·L-1;
②c(Na+)=0.05 mol·L-1
联系①②可得:c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol·L-1
C.不正确,混合溶液呈酸性,溶液中CH3COOH的电离程度大于CH3COONa的水解程度
D.不正确,溶液中离子浓度的大小关系为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
本题难度:一般
5、选择题 0.1 mol / L Na2CO3和0.1 mol / L NaHCO3溶液的pH值比较( )
A.大于
B.等于
C.小于
D.不能肯定
参考答案:A
本题解析:Na2CO3溶液中CO32?水解,NaHCO3溶液中HCO3?水解,CO32?的水解程度大于HCO3?的水解,所以0.1 mol / L Na2CO3溶液的pH大,故A项正确。
考点:本题考查盐类水解程度的比较。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《硫及其化合.. | |