微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2009年10月1日为庆祝祖国60华诞的联欢晚会在北京天安门广场举行,当晚8时许,璀璨的焰花从天安门广场四面八方腾空而起、交相辉映,把整个联欢晚会现场烘托得热烈喜庆。其中开篇"60"字样的高空焰火,象征民族大团结的56个“笑脸”、60支和平鸽让数万观众眼前为之一亮。这写都与高中化学中“焰色反应”知识相关。下列说法中正确的是?(?)

A.焰色反应均应透过蓝色钴玻璃观察
B.NaC1与Na2CO3灼烧时火焰颜色相同
C.非金属单质燃烧时火焰均为无色
D.所有金属及其化合物灼烧时火焰均有颜色
参考答案:B
本题解析:解析:焰色反应是部分金属元素的性质,并非所有金属都有焰色反应。只要同一中元素,不论其化合态还是游离态都具有相同的焰色反应现象,故B项正确;只有钾元素的焰色反应才透过蓝色钴玻璃观察,A项错误;氢气燃烧时火焰为淡蓝色,C项错误。
本题难度:简单
2、实验题 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题
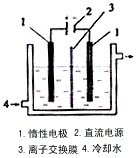
(1)碘是_________(填颜色)固体物质,实验室常用_________方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+
3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为______________________;阴极上观察到的实验现象是____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有
I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。

(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下

步骤②的操作名称是________________,步骤⑤的操作名称是________________。步骤④洗涤晶体的目的是___________________________。
参考答案:(1)紫黑色;升华
(2)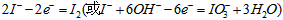 ;有气泡产生
;有气泡产生
(3)实验方法:取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉试液,观察是否变蓝。
现象及结论:如果不变蓝,说明无I-。(如果变蓝,说明有I-。)
(4)冷却结晶;干燥;洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
本题解析:
本题难度:困难
3、选择题 下列实验方案合理的是(?)
A.除去苯中的少量苯酚:加入浓溴水振荡、静置后过滤,除去三溴苯酚沉淀
B.检验酒精中的少量水:向酒精中加入足量生石灰
C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应
D.除去乙烯中杂质气体:将实验室制得的乙烯气体通入NaOH 溶液
参考答案:D
本题解析:A不正确,因为生成的三溴苯酚能溶解在苯中,应该用氢氧化钠溶液;B不正确,应该用无水硫酸铜;C不正确应该通过氯化氢和乙烯的加成反应,所以正确的答案选D。
点评:该题容易错选A。这是由于只考虑到将杂质除去,而忽略了不能在引入杂质这一原则。
本题难度:一般
4、填空题 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
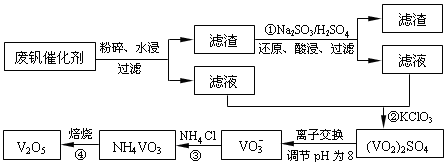
部分含钒物质在水中的溶解性如下:
物质
| VOSO4
| V2O5
| NH4VO3
| (VO2)2SO4
|
溶解性
| 可溶
| 难溶
| 难溶
| 易溶
|
?
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为_____________。
(2)滤液中含钒的主要成分为______________(填化学式)。
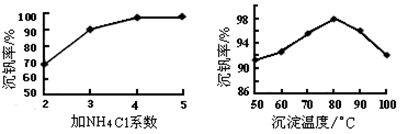
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式____;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为___________、_________℃。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O,其中n、m分别为______________、________ 。
(5)全钒液流电池的电解质溶液为VOSO4溶液,电池的工作原理为: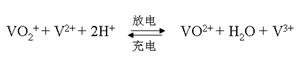
电池放电时正极的电极反应式为?。
参考答案:(15分)(1)V2O5(1分)(2)VOSO4(2分)(3)NH4++VO3- =NH4VO3↓(2分);
4(2分);80(2分) (4)2(2分);2(2分) (5)VO2++ 2H++e-= VO2++H2O(2分)
本题解析:(1)铝和五氧化二钒发生铝热反应的方程式为:3V2O5+10Al 6V+5Al2O3,反应中氧化剂是V2O5;
6V+5Al2O3,反应中氧化剂是V2O5;
(2)根据溶解性表知,V2O5难溶,VOSO4可溶,因此滤渣是V2O5,滤液中含矾的主要成分的化学式为VOSO4;
(3)根据NH4VO3难溶可知,反应③是复分解反应,方程式为NH4++VO3- =NH4VO3↓;根据图像可知氯化铵系数为4、温度为80℃时沉淀率最高,所以最佳控制氯化铵系数和温度为4和80℃。
(4)根据方程式2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O可知草酸中碳元素的化合价从+3价升高到+4价,失去1个电子,1mol草酸失去2mol电子,则根据电子得失守恒可知氧化剂得到2mol电子,所以1mol VO2+得到1mol电子,V元素的化合价从+5价降低+4价,因此n=2;根据氢原子守恒可知m=2。
(5)放电是原电池,正极得到电子,则根据总反应式可知,放电时VO2+得到电子,电极反应式为 VO2++ 2H++e-=VO2++H2O。
本题难度:一般
5、实验题 (8分) 实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
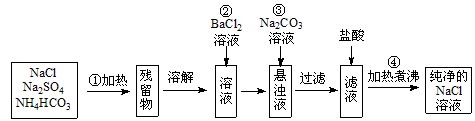
如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为?。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。
参考答案:(每空2分,共8分)(1)26.3g/mol?
(2)改用Ba(NO3)2会使溶液中引入新的杂质离子NO3—,以后操作中无法除去
(3)发生反应BaCl2+Na2CO3=BaCO3↓+2NaCl用以除去过量的Ba2+
(4)除去溶解在溶液中的二氧化碳
本题解析:(1)碳酸氢铵分解的化学方程式是NH4HCO3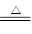 NH3↑+H2O+CO2↑,所以混合气的平均相对分子质量是
NH3↑+H2O+CO2↑,所以混合气的平均相对分子质量是 ,因此混合气的平均摩尔质量是26.3g/mol。
,因此混合气的平均摩尔质量是26.3g/mol。
(2)除杂是不能在引入新的杂质,而改用Ba(NO3)2会使溶液中引入新的杂质离子NO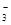 ,以后操作中无法除去,因此不能改为加硝酸钡溶液。
,以后操作中无法除去,因此不能改为加硝酸钡溶液。
(3)由于溶液中还有钡离子,所以加入碳酸钠的目的是除去过量的Ba2+。
(4)加入盐酸酸化时,会生成CO2气体。而溶液中有溶解的CO2,所以加热煮沸的目的是除去溶解在溶液中的CO2。
本题难度:一般