微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 过碳酸钠(2Na2CO4·3H2O)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中。依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下:
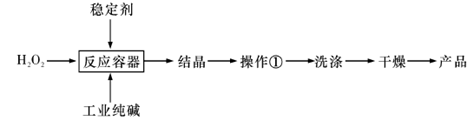
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液显?(填“酸性”、“碱性”或“中性”)。请用离子方程式表示:______________________。
(2)操作①需要的玻璃仪器有?(填写仪器名称)。
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
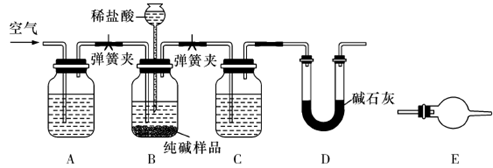
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的__________(选填序号)。
a. 氢氧化钡溶液?b. 稀硝酸? c. 硫氰化钾溶液?d. 硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若观察到?说明装置不漏气。
③装置A的作用是?,装置C中的试剂为?。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要??(选填“必要”或“不必要”),判断的理由是?。
参考答案:(1) 碱性(1分)? CO42– + H2O  ?HCO4– + OH–
?HCO4– + OH–
(2)漏斗(1分)?烧杯(1分)?玻璃棒(1分)
(3) ①bd?②漏斗内的水面高于瓶内的水面,且保持一段时间不变?③吸收空气中的CO2,避免干扰,并赶走装置中滞留的气体?浓硫酸(1分)?④必要(1分)?避免空气中的CO2进入D装置,提高实验的准确性
本题解析:(1)过碳酸钠大量用于洗涤,可推测其显碱性,因为过碳酸根离子水解呈碱性:CO42– + H2O  ?HCO4– + OH–。(2)从溶液中分离出晶体,在实验室应采用过滤的方法,过滤操作需要的玻璃仪器漏斗、烧杯、玻璃棒。(3)①检验纯碱中是否含量有NaCl杂质,应先加入AgNO3溶液,再加入过量的稀HNO3,若仍有白色溶液,说明溶液中含有Cl–,故选bd;②漏斗内的水面高于瓶内的水面,且保持一段时间不变,则说明装置不漏气;③本实验设计原理为通过测定生成的CO2的质量确定纯碱中Na2CO3的含量,所以B装置内滞留的气体应能被D装置中的碱石灰充分吸收,设计A装置的目的就是通过鼓入空气赶走B装置中滞留的气体,但又不能让空气中的CO2影响测定结果,因此A装置中所盛溶液必须能除去空气中的CO2,设计C装置的目的是除去CO2中混合的水蒸气,故装置A的作用是:吸收空气中的CO2,并赶走装置中滞留的气体,装置C中的试剂为:浓硫酸;④定量实验应尽量精确,减小误差,实验中需要称量的是实验前后D装置的质量,如果空气中的CO2进入D装置会造成实验误差,影响实验的精确度,所以D装置后必须连接一个E装置。
?HCO4– + OH–。(2)从溶液中分离出晶体,在实验室应采用过滤的方法,过滤操作需要的玻璃仪器漏斗、烧杯、玻璃棒。(3)①检验纯碱中是否含量有NaCl杂质,应先加入AgNO3溶液,再加入过量的稀HNO3,若仍有白色溶液,说明溶液中含有Cl–,故选bd;②漏斗内的水面高于瓶内的水面,且保持一段时间不变,则说明装置不漏气;③本实验设计原理为通过测定生成的CO2的质量确定纯碱中Na2CO3的含量,所以B装置内滞留的气体应能被D装置中的碱石灰充分吸收,设计A装置的目的就是通过鼓入空气赶走B装置中滞留的气体,但又不能让空气中的CO2影响测定结果,因此A装置中所盛溶液必须能除去空气中的CO2,设计C装置的目的是除去CO2中混合的水蒸气,故装置A的作用是:吸收空气中的CO2,并赶走装置中滞留的气体,装置C中的试剂为:浓硫酸;④定量实验应尽量精确,减小误差,实验中需要称量的是实验前后D装置的质量,如果空气中的CO2进入D装置会造成实验误差,影响实验的精确度,所以D装置后必须连接一个E装置。
本题难度:困难
2、选择题 若要除去下列有机物中混入的杂质(括号中为杂质),所选用的方法不正确的是( )
A.乙醇(水):加入新制的生石灰,然后蒸馏
B.苯(苯酚):加入氢氧化钠,然后分液
C.乙炔(乙烯):通入酸性高锰酸钾溶液中洗气
D.乙酸乙酯(乙酸):加入饱和碳酸钠溶液,然后分液
参考答案:A.水和生石灰反应生成氢氧化钙,乙醇易挥发,可用蒸馏的方法分离,故A正确;
B.苯酚与NaOH反应生成可溶于水的苯酚钠,苯和水互不相溶,可用分液的方法分离,故B正确;
C.乙炔和乙烯都能与酸性高锰酸钾反应,不能用酸性高锰酸钾溶液分离,故C错误;
D.乙酸与碳酸钠反应而被吸收,乙酸乙酯不溶于饱和碳酸钠溶液,可用饱和碳酸钠溶液分离,故D正确.
故选C.
本题解析:
本题难度:一般
3、选择题 下列各组有机物只用一种试剂无法鉴别的是
A.乙醇、苯、硝基苯
B.苯、己烷、溴苯
C.苯、乙酸、己烯
D.苯、乙醛、乙酸
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (8分)
在下表中填入除去各粉末状混合物中的杂质(括号内为杂质)所用的试剂。将所选试剂的代号填入表内“试剂”栏相应的空格内。
可供选择的试剂:
A.盐酸,
B.氢氧化钠溶液,
C.氧气,
D.水,E.二氧化碳