微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分) 右图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
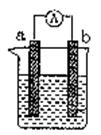
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置 (填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入 极(填a或b,下同),电子从 极流出。a极发生电极反应式为:_________________________
参考答案:(1)2H++2e=H2(2分)能,正,镁;负,铝各1分
(3)B,B 各1分 4H+ + O2+ 4e-= 2H2O 2分
本题解析:略
本题难度:一般
2、选择题 如图装置所示,铜片上发生的反应为
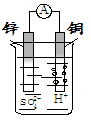
A.Zn2+ + 2eˉ = Zn
B.2H+ + 2eˉ = H2↑
C.Zn - 2eˉ= Zn2+
D.Cu2+ + 2eˉ = Cu
参考答案:B
本题解析:该原电池的总反应为Zn2+ +2H+=Zn+ H2↑,负极锌片上的电极反应为Zn - 2eˉ=? Zn2+,正极铜片上的电极反应为2H+ + 2eˉ = H2↑,故B项正确。
本题难度:一般
3、选择题 某学生欲完成反应2HCl+2Ag==2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是
[? ]
A.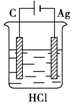
B.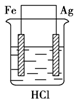
C.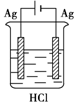
D.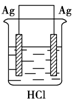
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列叙述正确的是
①原电池是将化学能转化为电能的一种装置?
②原电池的正极发生氧化反应,负极发生还原反应?
③不能自发进行的氧化还原反应,通过原电池装置可以实现?
④碳棒不能用来作原电池的正极?
⑤反应Cu+2Ag+?= Cu2++2Ag?能以原电池的形式实现
A.②⑤
B.①④⑤
C.②③④
D.①⑤
参考答案:D
本题解析:原电池的正极发生还原反应,负极发生氧化反应,②不正确。只有自发进行的氧化还原反应,才能通过原电池装置实现,③不正确。④不正确,碳棒可以导电,可用作电极,所以正确的答案是①⑤,答案选D。
本题难度:简单
5、选择题 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可作空军通信卫星的电源,其工作原理如下图所示,
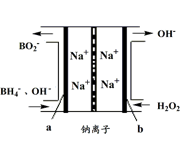
下列说法正确的是
A.每消耗3mol H2O2,转移的电子为3mol
B.电池放电时,Na+从a极区移向b极区
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+