微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温下,将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,下列说法正确的是
A.该溶液的物质的量浓度: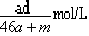
B.所得气体体积为44.8aL
C.该溶液的质量分数: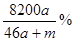
D.向溶液中通入过量CO2,未见白色沉淀
参考答案:C
本题解析:amol钠溶于水生成amol氢氧化钠和0.5amol氢气,生成的氢氧化钠恰好与铝反应生成amol偏铝酸钠和1.5amol氢气,因此生成的氢气总共是2amol,但体积不一定是44.8aL,B不正确;偏铝酸钠吸收CO2生成氢氧化铝沉淀,D不正确;反应后溶液的质量是23a+27a+m-4a=(46a+m)g,溶液的体积是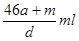 ,所以A不正确;溶质是偏铝酸钠,质量是82ag,所以选项C正确,答案选C。
,所以A不正确;溶质是偏铝酸钠,质量是82ag,所以选项C正确,答案选C。
本题难度:一般
2、填空题 用锌片与稀硫酸反应,实验结果记录如表
次数
| 加入Zn质量/g
| 加入稀硫酸质量/g
| 生成ZnSO 4 质量/g
|
1
| 2
| 60
| 5
|
2
| 4
| 60
|
|
3
| 6
| 60
| 15
|
4
| 8
| 60
| 17
|
5
| 10
| 60
|
|
6
| 12
| 60
| 17
|
(1)第2、5两次产生ZnSO4 的质量依次是______________g.
(2)在图中画出ZnSO4 与Zn的质量函数关系的曲线.

(3)(10+m)g锌与60g稀硫酸充分反应后,剩余固体的质量为______________g.
(4)稀硫酸的溶质质量分数是______________.
参考答案:(1)10g、17g
(2)如图(若没有标出坐标值不对.根据硫酸锌的质量可以计算消耗锌的质量为6.9g)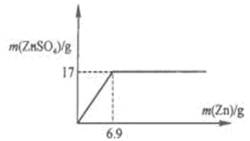
(3)(3.1g+m)g ; (4)17.2%
本题解析:根据表格中前4次的数据可以看出:硫酸的质量不变,Zn的质量增加,产生的ZnSO4 质量也逐渐增加,说明硫酸过量,原因第2次的质量是第一次的2倍,所以产生的ZnSO4质量也是第一次的2倍,质量是2×5g=10g;第四次产生ZnSO4质量是17g,第6次Zn质量增加,而产生的ZnSO4质量不变,说明硫酸反应完全,所以第5次加入Zn质量是10g时产生的ZnSO4质量也是17g;(2)65gZn完全反应会产生161g ZnSO4,则产生17g ZnSO4消耗的Zn的质量是:(17×65g)÷161=6.9g,则ZnSO4 与Zn的质量函数关系的曲线是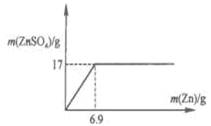 ;
;
(3)(10+m)g锌与60g稀硫酸充分反应后产生ZnSO4质量是17g,消耗Zn的质量是6.9gZn质量再增加,也不会发生反应,所以剩余固体的质量为(10+m)g-6.9g=(3.1g+m)g;(4)根据质量守恒定律可知在17g ZnSO4中含有的SO42-的质量是17g-6.9g=10.1g,则消耗的硫酸的质量是(98÷96)×10.1g=10.3g,所以稀硫酸的溶质质量分数是(10.3g÷60g)×100%=17.2%。
考点:考查实验数据的处理、图像法表示、物质的质量关系及溶液的质量分数的计算的知识。
本题难度:一般
3、选择题 下列关于物质的量、摩尔质量的叙述正确的是(?)
A.0.012 kg 12C中含有约6.02×1023个碳原子
B.1 mol H2O中含有2 mol氢和1 mol氧
C.氢氧化钠的摩尔质量是40 g
D.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍
参考答案:A
本题解析:B项,应表达为1 mol H2O中含有2 mol氢原子和1 mol氧原子;C项,单位错误,应是40 g·mol-1;D项,水的摩尔质量是固定不变的。
本题难度:一般
4、选择题 设NA为阿佛加德罗常数,下列说法不正确的是
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B. 18g水中含有的电子数为10NA
C. 46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D.在1 L 2 mol?L—1的硝酸镁溶液中含有的硝酸根离子数为4NA
参考答案:A
本题解析:考查阿伏加德罗常数的有关计算和判断。标准状况下,辛烷不是气体,不能适用于气体摩尔体积,选项A不正确,其余选项都是正确的,答案选A。
本题难度:一般
5、填空题 (3分)0.6 mol的氧气与0.4 mol臭氧 O3质量之比为?, 分子个数之比为?, 氧原子个数之比为? ?。
?。
参考答案:1:1?3:2?1:1
本题解析:略
本题难度:简单