微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。
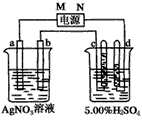
通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是____________,其质量为____________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:
2∶____________∶____________∶____________。
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”。下同)____________,AgNO3溶液的pH
____________,H2SO4溶液的浓度____________,H2SO4溶液的pH____________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为____________g。
参考答案:(1)正
(2)Ag;2.16
(3)2∶0.5∶1
(4)不变;不变;增大;减小
(5)45.18
本题解析:
本题难度:一般
2、填空题 (共12分)
电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
(1)某兴趣小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为_______________________。
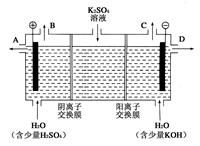
②得到的氢氧化钾从 (填A,或D)排放出。常温下,若将得到的2L浓度为0.25mol/L的KOH溶液与2L0.025mol/L的硫酸溶液混合(假设溶液混合后忽略体积变化),pH为
③此时通过阴离子交换膜的离子数 (填大于,小于或等于)通过阳离子交换膜的离子数。
④若将制得的氢气、氧气和硫酸溶液组合为氢氧燃料电池,则电池正极的电极反应式为____________________________________________
(2)如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。
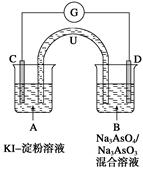
①向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是______________________,D电极上的电极反应式为______________________。
②一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置的总的离子方程式为__________________________。
参考答案:(1)1分 ① 2H2O-4e-="==" O2 +4H+或 4OH- -4e-===2H2O + O2
②D(1分),13(1分) ③小于 (1分)
④4H+ +O2+4e- ===2H2O (2分)
(2)①无色溶液变成蓝色(2分) +2H++2e-===
+2H++2e-=== +H2O(2分)
+H2O(2分)
②I2+ +H2O===2H++2I-+
+H2O===2H++2I-+ (或I2+
(或I2+ +2OH-===H2O+2I-+
+2OH-===H2O+2I-+ )(2分)
)(2分)
本题解析:(1)①电解池的阳极发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;
②钾离子向阴极移动,所以KOH在阴极得到,则KOH从D口放出;2L浓度为0.25mol/L的KOH溶液中KOH的物质的量是0.5mol,2L0.025mol/L的硫酸溶液中硫酸的物质的量是0.05mol,所以KOH过量,混合后的氢氧根离子浓度是(0.5mol-0.05mol×2)/4L=0.1mol/L,所以溶液的pH=-lgc(H+)=13;
③阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钾离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;
④燃料原电池中,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,该燃料原电池中,氧气是氧化剂,所以氧气在正极上得电子和氢离子结合生成水,电极反应式为4H+ +O2+4e- ===2H2O;
(2)①向B杯中加入适量较浓的硫酸,发现G的指针向右偏移,“G是灵敏电流计,其指针总是偏向电源正极”,所以说电子从C跑到D,则D是正极,C是负极,A中碘离子发生氧化反应,失去电子,生成碘单质遇到淀粉变蓝,D中浓硫酸将低价的亚砷酸根离子氧化,该离子发生还原反应,电极反应式为:AsO43-+2H++2e-=AsO32-+H2O;
②再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移,说明C是正极,D是负极,A中发生碘单质失电子的反应,B中发生亚砷酸失电子的反应,总反应为:AsO32-+I2+2H2O=2H++2I-+AsO43-。
考点:考查电化学反应原理的应用
本题难度:一般
3、选择题 在25℃时,用铂电极电解一定量的Na2SO4饱和溶液,一段时间后,阳极析出amol气体,同时溶液中析出bg Na2SO4·10H2O,如果在这一过程中温度不变,则此时Na2SO4溶液中溶质的质量分数为(?)
A.(71/161)×100℅
B.〔71b/161(18a+b)〕×100℅
C.〔b/(18a+b)〕×100℅
D.〔71b/161(36a+b)〕×100℅
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (14分)NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
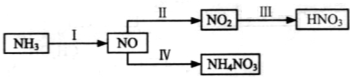
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
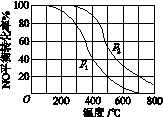
①比较p1、p2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
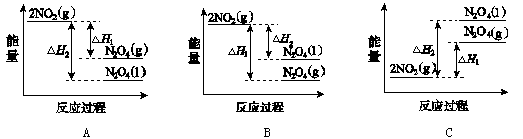
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
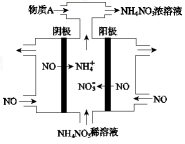
为使电解产物全部转化为NH4NO3,需补充A。A是 ,说明理由: 。
参考答案:(14分)
(1)4NH3+5O2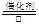 4NO+6H2O
4NO+6H2O
(2)①p1<p2 ②减小
(3)①A ②2N2O4+O2+2H2O===4HNO3
(4)NH3根据反应:8NO+7H2O 3NH4NO3+2HNO3,电解产生的HNO3多
3NH4NO3+2HNO3,电解产生的HNO3多
本题解析:(1)氨在催化剂的作用下与氧气反应生成NO和水,其化学方程式是4NH3+5O2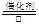 4NO+6H2O。
4NO+6H2O。
(2)①2NO(g)+O2(g)  2NO2(g),该反应是气体体积减小的可逆反应,增大压强,平衡向右移动,NO的平衡转化率升高,所以p1、p2的大小关系为p1<p2;②升高温度,NO的平衡转化率降低,说明平衡逆向移动,而升高温度,平衡向吸热反应方向移动,则该反应的正向反应是放热反应,对于放热反应,升高温度,化学反应平衡常数减小。
2NO2(g),该反应是气体体积减小的可逆反应,增大压强,平衡向右移动,NO的平衡转化率升高,所以p1、p2的大小关系为p1<p2;②升高温度,NO的平衡转化率降低,说明平衡逆向移动,而升高温度,平衡向吸热反应方向移动,则该反应的正向反应是放热反应,对于放热反应,升高温度,化学反应平衡常数减小。
(3)①2NO2(g) N2O4(g)ΔH1和2NO2(g)
N2O4(g)ΔH1和2NO2(g) N2O4(l)ΔH2都是放热反应,反应物的能量高于生成物的能量,C图错误;同一物质气态时的能量高于液体时的能量,A图正确;B图错误;选A。
N2O4(l)ΔH2都是放热反应,反应物的能量高于生成物的能量,C图错误;同一物质气态时的能量高于液体时的能量,A图正确;B图错误;选A。
②N2O4与O2、H2O反应生成硝酸,化合的化学方程式是2N2O4+O2+2H2O===4HNO3。
(3)根据电解示意图可知,电解NO制备硝酸铵,阳极反应为:NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出若要使电子得失守恒,阳极产生的NO3-的量大于阴极产生的NH4+的量,总反应为8NO+7H2O 3NH4NO3+2HNO3,应补充适量的氨气,则理由为根据反应8NO+7H2O
3NH4NO3+2HNO3,应补充适量的氨气,则理由为根据反应8NO+7H2O 3NH4NO3+2HNO3,电解产生的HNO3多。
3NH4NO3+2HNO3,电解产生的HNO3多。
考点:考查化学反应的书写,影响化学平衡的因素,化学图像的分析及电解的应用。
本题难度:困难
5、选择题 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用右图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )
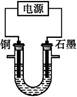
A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是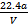
D.石墨电极上发生的反应是4OH--4e- O2↑+2H2O
O2↑+2H2O
参考答案:D
本题解析:若黑色粉末X是铁粉,则掺入了新的杂质Fe2+,X应为CuO;此装置因为有气体生成,所以是电解CuSO4溶液,阳极电极反应为4OH--4e- 2H2O+O2↑、阴极电极反应式为Cu2++2e-
2H2O+O2↑、阴极电极反应式为Cu2++2e- Cu,铜接电源负极,D正确;氧气的体积单位为mL,铜的相对原子质量的计算式为
Cu,铜接电源负极,D正确;氧气的体积单位为mL,铜的相对原子质量的计算式为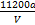 ,C选项错误
,C选项错误
本题难度:一般